 |
|
Определение теплоты растворения соли
Цель работы: экспериментальное определение одной из важнейших термодинамических характеристик процесса растворения – молярной интегральной энтальпии растворения.
Реактивы: соли KCl, KBr, KNO3, K2SO4, NH4NO3, твердый раствор KCl×KBr и др. (по указанию преподавателя), дистиллированная вода.
Теоретические сведения
Тепловой эффект растворения 1 моль или 1 г вещества называют соответственно молярной или удельной теплотой растворения. Теплота растворения зависит от концентрации раствора. Различают интегральную и дифференциальную теплоты растворения.
Интегральная теплота растворения – это тепловой эффект, сопровождающий процесс растворения одного моль (молярная) или 1 г (удельная) вещества в данном количестве растворителя.
Дифференциальная теплота растворения – тепловой эффект, сопровождающий процесс растворения 1 моль вещества в бесконечно большом количестве раствора заданной концентрации.
Интегральные теплоты растворения определяют экспериментально, а дифференциальные теплоты вычисляют по зависимости интегральных теплот от концентрации раствора.
Порядок выполнения работы
1. Опыт по растворению соли.
Подготовить калориметрическую установку к работе
(см. рис. 1.1). Налить в сосуд 900 см3 дистиллированной воды, соединить его с крышкой 4, закрепив на штативе, включить мешалку тумблером 9 на панели. Тумблером 8 включить регистрирующий прибор (мультиметр) и с помощью магазина сопротивлений установить необходимый диапазон и чувствительность измерений. Показания регистрирующего прибора снимать через каждые 30 с. Для записи температурного хода можно измерять любую величину, пропорциональную температуре, – омическое сопротивление термометра, падение напряжения в цепи термометра и др.
После завершения предварительного периода внести в сосуд через воронку взвешенную массу исследуемого вещества, фиксируя показания прибора через каждые 30 с до завершения главного и заключительного периодов (при работающей мешалке).
2. Опыт по определению теплоемкости калориметрической системы.
Заключительный этап первого опыта является предварительным этапом опыта по определению теплоемкости калориметрической системы (рис. 1.2). В главном периоде второго опыта тумблером 8 включить нагреватель 7. При этом автоматически включается электросекундомер. Записать показания вольтметра и амперметра, установленных на панели. Продолжительность пропускания тока не должна превышать 3 мин. Выключить нагреватель, записать точное время пропускания тока t. В ходе всего опыта непрерывно снимать показания мультиметра через каждые 30 с. После окончания опыта выключить мешалку и регистрирующий прибор, освободить сосуд и вылить его содержимое. Полученные результаты внести в табл. 1.1.
Т а б л и ц а 1.1
Исследуемое вещество –______ ; масса вещества m = ______ г;
сила тока I = _____ А; напряжение U = _______ В;
время пропускания тока tн = ______с.
| Продолжительность опыта, с | |||||||
| Показания прибора |
Обработка опытных данных
1. Результаты представить в виде графической зависимости температуры или другой величины, пропорциональной температуре, от времени (рис. 1.2). По графику определить изменение температуры в процессе растворения кристаллического вещества DТ1 и при нагревании жидкости DТ2.
2. Тепловой эффект растворения (или энтальпию растворения DmН) вычислить по формуле
Q1 = DmН = СкDТ1. (1.24)
3. Тепловое значение калориметра найти по уравнению
Ск = Q2/DТ2, (1.25)
где DТ2 – изменение температуры при нагревании, К; Q2 – теплота, подведенная от электрического нагревателя, Дж;
Q2 = IUtн, (1.26)
где I – сила тока, А; U – напряжение, В; tн – время пропускания тока (продолжительность нагревания), с.
Совместным решением уравнений (1.24)-(1.26) легко получить формулу для вычисления интегральной теплоты растворения (или энтальпии растворения DmН)
Q1 = IUtн(DТ1/DТ2).
Очевидно, что изменение температур можно заменить длиной соответствующих отрезков mm' и nn' (рис. 1.2).
Молярную энтальпию растворения рассчитать по формуле
 ,
,
где n – число моль растворенного вещества; n = m/M, m – масса вещества, г; M – молярная масса вещества, г/моль.
Для вычисления молярной массы твердого раствора использовать соотношение
Mтв.р. = х1M1 + x2M2,
в котором М1 и М2, х1 и х2 – соответственно молярные массы и мольные доли солей, образующих твердый раствор,
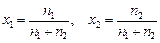 ,
,
где n1, n2 – число моль компонентов, образующих твердый раствор.
Экспериментально найденные значения интегральных молярных теплот растворения индивидуальных веществ сравнить со справочной величиной [2], вычислить относительную погрешность.
Контрольные вопросы и задания
1. Сформулируйте первый закон термодинамики. Напишите математическое выражение первого закона термодинамики для бесконечно малого и конечного изменения состояния системы.
2. Приведите запись первого закона термодинамики для изохорного, изобарного, изотермического и адиабатического процессов.
3. Что такое тепловой эффект процесса? Приведите уравнение, связывающее изобарный и изохорный тепловые эффекты. В каких случаях для химических реакций можно пренебречь разницей между DН и DU?
4. Что называют изобарной и изохорной теплоемкостью вещества? Приведите интерполяционное уравнение зависимости теплоемкости от температуры.
5. Как зависит тепловой эффект процесса от температуры, и чем определяется характер этой зависимости?
6. Что такое интегральная и дифференциальная теплоты растворения?
7. Опишите схему калориметрической установки и методику калориметрического измерения интегральной теплоты растворения.
Лабораторная работа № 2