 |
|
Приклади розв’язування задач. Газові закони
Задачі на розрахунок параметрів стану ідеального газу можна розподілити на дві основні групи. До першої належать задачі, в яких у разі зміни будь-якого з параметрів маса ідеального газу залишається сталою. Причому маса газу може бути не заданою. Тоді задачі можна розв’язувати за об’єднаним газовим законом, частковим випадком якого залежно від сталих параметрів є закони Бойля – Маріотта , Гей-Люссака, Шарля.
До другої групи належать задачі із заданою або змінною масою. До них застосовний закон Клапейрона-Менделєєва, причому його записують для кожного стану ідеальних газів. Одержану систему рівнянь, з урахуванням додаткових умов, розв’язують відносно шуканої величини.
Задача 1. У вертикальному циліндрі під поршнем газ знаходиться при температурі 300 К. Маса поршня 4 кг, площа його 0,004 м2. Якої маси вантаж потрібно покласти на поршень, щоб він залишився на місці під час повільного нагрівання газу на 50 К? Атмосферний тиск 105 Па, прискорення вільного падіння 10 м/с2.
Дано:
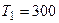 К, К,
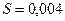 м2,
m = 4 кг, м2,
m = 4 кг,
 K, K,
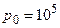 Па, Па,
 м/с2. м/с2.
| Розв’язування
Газ під поршнем знаходитиметься у двох станах. Стан газу описується параметрами 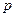 , , 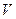 , , 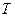 . У першому стані тиск визначатиметься атмосферним тиском і тиском поршня: . У першому стані тиск визначатиметься атмосферним тиском і тиском поршня:  ; ; 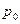 – задано. Тиск поршня знаходимо за означенням тиску – задано. Тиск поршня знаходимо за означенням тиску 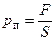 ; ;  . Отже, . Отже,  . Температуру початкового стану задано умовою задачі. Об’єм газу вважатимемо . Температуру початкового стану задано умовою задачі. Об’єм газу вважатимемо 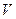 . .
|
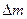 =? =?
|
У другому стані тиск  збільшиться за рахунок тиску, що створюється вантажем
збільшиться за рахунок тиску, що створюється вантажем 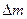 , покладеним на поршень:
, покладеним на поршень:
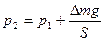 .
.
Температуру другого стану 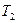 визначаємо умовою
визначаємо умовою  . Оскільки поршень залишається в попередньому стані, то об’єм зберігатиметься. Отже, для розв’язування задачі можна використати закон Шарля:
. Оскільки поршень залишається в попередньому стані, то об’єм зберігатиметься. Отже, для розв’язування задачі можна використати закон Шарля: 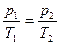 . Підставляючи вирази для
. Підставляючи вирази для  і
і  , знаходимо
, знаходимо
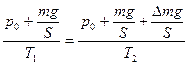 ,
,
де  . Звідки:
. Звідки:
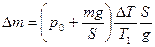 .
.
Перевіримо одиниці вимірювання:
 .
.
Підставляючи числові дані, остаточно отримаємо:
 кг.
кг.
Відповідь:  = 7,3 кг.
= 7,3 кг.
Задача 2. Об’єм повітря в кімнаті 100 м3. Яка маса повітря, що вийшло з кімнати у результаті підвищення температури від 10 до 25 ºС, якщо атмосферний тиск дорівнює 770 мм рт. ст.?
Дано:
 м3, м3,
 К, К,
 К, К,

 , ,
 . .
| Розв’язування
Розглянемо масу повітря в кімнаті за умов  , , 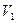 , , 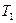 і порівняємо її з нормальними умовами, використовуючи рівняння Клапейрона: і порівняємо її з нормальними умовами, використовуючи рівняння Клапейрона:
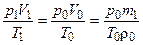 .
Звідси: .
Звідси:
 .
З підвищенням температури об’єм і тиск не змінюються, але маса повітря в кімнаті буде іншою – .
З підвищенням температури об’єм і тиск не змінюються, але маса повітря в кімнаті буде іншою – 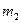 . Порівняємо її зі станом . Порівняємо її зі станом
|
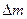 =? =?
|
за нормальних умов:
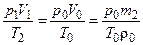 ,
,
звідки:
 .
.
Таким чином, маса повітря, що вийшла:
 ;
;
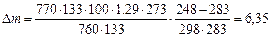 кг.
кг.
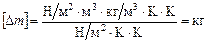 .
.
Відповідь: 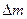 = 6,35 кг.
= 6,35 кг.
Задача 3. Скільки молекул повітря міститься в кімнаті об’ємом 240 м3 при температурі 15 ºС і тиску 750 мм. рт. ст.?
Дано:

 , ,
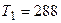 К, К,
 , ,
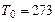 К, К,
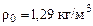 , ,
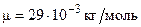 , ,
 . .
| Розв’язування
Щоб скласти рівняння Клапейрона, порівняємо між собою стан заданої маси повітря у двох випадках: за заданих умов  , , 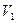 , , 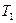 і за нормальних умов і за нормальних умов 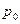 , , 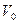 , ,  . Тоді . Тоді 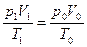 або, оскільки або, оскільки  , де , де  – густина за нормальних умов, то – густина за нормальних умов, то  . Звідки: . Звідки:  . Знайдемо, скільки повітря (в молях) є в цій масі: . Знайдемо, скільки повітря (в молях) є в цій масі:
 .
Але відомо, що в одному молі будь-якої речовини, в тому числі і повітря, міститься число молекул, яке дорівнює числу .
Але відомо, що в одному молі будь-якої речовини, в тому числі і повітря, міститься число молекул, яке дорівнює числу
|
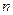 =? =?
|
Авогадро 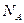 . Отже, повне число молекул в кімнаті дорівнює:
. Отже, повне число молекул в кімнаті дорівнює:
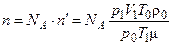 ;
;
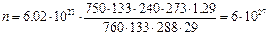 .
.
Відповідь: 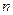 = 6·1027.
= 6·1027.
Вправа 10
1 (п). Визначте середню кінетичну енергію поступального руху молекул ідеального газу з концентрацією 3∙10 25 м – 3 за тиску 10 5 Па.
2 (п). Визначте середню квадратичну швидкість розрідженого газу густиною 4,1∙10 – 2 кг/м 3 за тиску 5∙10 4 Па.
3 (п). Під яким тиском знаходиться кисень, якщо теплова швидкість його молекул 500 м / с, а їх концентрація 10 25 м – 3?
4 (д). Знайдіть кількість молекул, що є у фізичному кабінеті за температури 20 ºС і нормального тиску.
5 (д). У колбі місткістю 200 мл знаходиться ідеальний газ за нормального тиску і температури 23 ºС. Знайдіть кількість молекул газу у колбі.
6 (д). За графіком, показаним на мал. 5.28, встановити, як змінюється об’єм ідеального газу під час переходу із стану 1 у стан 2. Маса газу не ділена легким рухомим поршнем, по різні боки від поршня знаходяться однакові маси кисню та водню за сталої температури. Визначити рівноважне положення поршня.
7 (с). Газ, що є хімічною сполукою С n H 2 n + 2 масою 16 кг, за тиску 105 Па і температури 300 К займає об’єм 24, 93 л . Що це за газ?
8 (с). Посудина об’ємом 20,5 м 3 містить суміш водню і гелію. Маса суміші 13 г, температура 27 ºС, тиск 5,4·10 5 Па. Визначте маси водню m1 і гелію m2 у суміші.
9 (в). Замкнений цикл (мал. 5.29) побудувати у координатах V, T і р, V
10 (в). Маємо дві посудини з газом: одна місткістю 3 л, друга – 4 л. У першій посудині газ перебуває під тиском 2 атм, а в другій – під тиском 1 атм. Під яким тиском буде газ, якщо посудини сполучити між собою. Вважати, що температура при цьому стала.