 |
|
Из ацетилена и синильной кислоты

Физические свойства, строение
Пиридин – бесцветная жидкость с неприятным запахом, т. кип. 115,5°С, растворим в воде, плотность больше 1.
Пиридин – шестичленный гетероароматический аналог бензола. Его плоская молекула имеет сопряженную систему из 6 π-электронов. Все атомы цикла находятся в состоянии sp2-гибридизации и вносят по одному р-электрону в ароматический секстет. Ввиду большой электроотрицательности атома азота электронная плотность в молекуле смещена в сторону азота и пиридин является электронодефицитным гетероциклом. У атома азота есть неподеленная пара электронов, которая обуславливает основные свойства пиридина. Пиридин инертен к электрофильным реагентам и обладает повышенной склонностью к реакциям с нуклеофилами.
Химические свойства
Из рассмотренного выше строения пиридина следует, что для него характерны основные свойства, а также возможны реакции присоединения и замещения.
1. Электрофильное замещение в пиридине протекает по β-полжению.
Хлорирование

Электрофильный реагент первоначально атакует атом азота, имеющий неподеленную пару электронов, тем самым еще больше увеличивая положительный заряд в кольце пиридина и затрудняя реакцию электрофильного замещения.
2) Бромирование. Реакция идет в жестких условиях:

Сульфирование

Нитрование

Если температура выше 400°С, можно получить с невысоким выходом 2-нитропиридин.
Преимущественная атака в положение 3 связана с меньшим по величине положительным зарядом на атоме углерода, чем в положения 2 и 4:

Кроме того, σ-комплекс при замещении в положение 3 может быть описан набором более выгодных резонансных структур, чем при замещении в положения 2 и 4 (отсутствует положительный заряд на атоме азота).
Атака в положение 3:

Атака в положение 2:
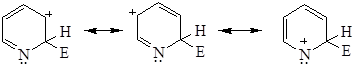
Реакции алкилирования и ацилирования пиридина невозможны.