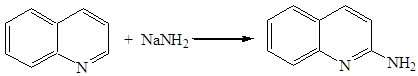|
|
Реакции пиридина как основания
1) Взаимодействие с минеральными кислотами. Пиридин обладает слабыми основными свойствами, К = 1,7·10-9. С минеральными кислотами дает соли:

2) Алкилирование по азоту. Пиридин легко алкилируется по азоту с образованием N-алкилпиридиновых оснований:

3) Образование N-окисей. При нагревании пиридина с уксусной кислотой и перекисью водорода образуется N-окись пиридина:
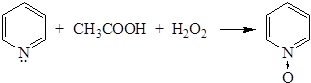
N-окись в отличие от пиридина значительно легче вступает в реакции электрофильного замещения.
Применение
Пиридин используют в качестве растворителя, для получения пестицидов, лекарственных веществ, пиперидина, аминопиридина.
ХИНОЛИН
Хинолин состоит из сконденсированных бензольного и пиридинового колец.
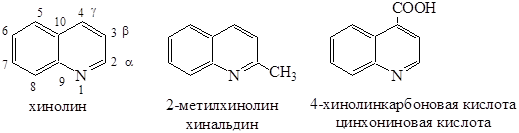
Хинолин входит в состав алкалоидов. Хинолиновые основания – бесцветные жидкости с характерным запахом. В воде растворимы меньше, чем пиридин и его гомологи.
Способы получения
Синтез Скраупа
На первой стадии происходит конденсация анилина с акролеином, затем дегидратация и дегидрированное окисление.
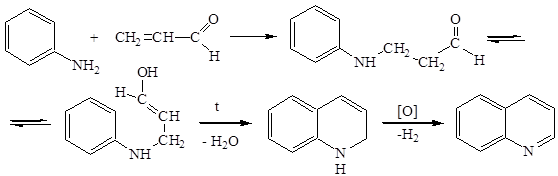
Если взять в качестве исходного соединения уксусный альдегид, то в результате реакции образуется 2-метилхинолин:


Строение хинолина
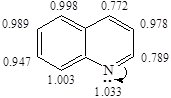
Влияние атома азота на бензольное кольцо выражено слабее, чем на пиридиновое кольцо. Реакции электрофильного замещения протекают легче, чем в пиридине. Так же протекают реакции нуклеофильного замещения, и хинолин проявляет основные свойства, как пиридин.
Химические свойства
Основные свойства
Образование солей с минеральными кислотами

Образование N-окисей
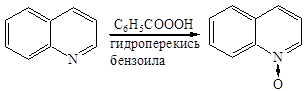
Реакции электрофильного замещения
Нитрование
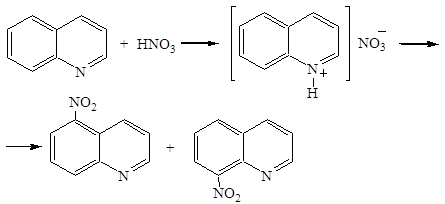
Сульфирование

Ацилирование и формилирование провести не удается, так как используемые агенты являются слабыми электрофилами.
Нуклеофильное замещение
Аминирование