 |
|
Молекула метана имеет тетраэдрическое строение
Демидов Владимир Александрович,
преподаватель химии, биологии,
экологии, учитель высшей категории
МОУ СОШ села Синегорье
Нагорского района Кировской области
Стаж работы – 10 лет
СИНЕГОРЬЕ – 2005.
ВВЕДЕНИЕ
Учителя предметники согласятся с мыслью о том, что тема «Углеводороды» является одной из ключевых, фундаментальных тем курса органической химии 10 класса. И это не случайно, хотя материал данной темы не очень сложен для усвоения учащимися, всё же от того насколько качественно усвоят учащиеся основные понятия этого раздела, зависит дальнейшее изучение органической химии в данной параллели. Ведь именно эта тема является своеобразным фундаментом, на который в дальнейшем будет наслаиваться новый материал.
Автор данной разработки, учитель высшей категории со стажем преподавания химии в средней школе более 10 лет, предлагает свой вариант подачи данной темы (включающей пять разделов курса органической химии 10 класса) в виде лекционных конспектов, которые будут очень полезны особенно начинающим учителям, на основе которых они смогут выбрать наиболее приемлемый вариант подачи данного материала в условиях своей школы. Помимо грамотного изложения научным языком, но в тоже время в очень доступной форме в разработке изложены не только теоретические вопросы темы, но в ней содержится большое количество задач с подробным решением и грамотным оформлением сгруппированных по разделам темы: «Алканы», «Циклопарафины», «Алкены», «Диены», «Алкины». Задачи, включенные в разработку, являются типовыми и включены в минимум необходимых знаний учащихся по химии за 10 класс. Кроме задач, разработка содержит подборку авторских тестовых заданий с указанием верного ответа на каждое задание для проверки степени усвоения теоретического материала учащимися на уроке. Используя задачи и тесты, приведённые в данной разработке, добавив один или два теоретических вопроса, учитель – предметник может скомпоновать свой вариант самостоятельной или контрольной работы для проверки знаний учащихся по тому или иному разделу темы «Углеводороды».
УГЛЕВОДОРОДЫ
Углеводороды – это наиболее простые органические соединения, в состав которых входят лишь два элемента углерод и водород. Общей формулой углеводородов может служить формула CxHy.
I Алканы или парафины– это алифатические[1] предельные углеводороды в молекулах, которых атомы углерода связанны между собой простой (одинарной) s - связью. Это сложные органические соединения с общей формулой CnH2n+2 , которые не способны присоединять молекулы водорода, галогенов и других соединений в силу валентной насыщенности атома углерода.
1. Электронное строение молекулы метана СН4:
|  |
№6, С (углерод) + 6 ) ) 1s22s22p2 …
2 4 валентные электроны 2s 2p
Однако в атоме углерода один электрон с 2s подуровня переходит на 2р подуровень, при этом углерод проявляет валентность четыре и обозначает С* - углерод в возбужденном состоянии.



|


|
|
№1, Н (водород) +1 ) 1s1 …
1 1s
Схема образования молекулы СH4:
Н H
+* . . d-
H* + *С* + Н ® H:С:H d+
* * * ` `
+ H
Н*
Для метана характерен ковалентный полярный тип связи.
Значком d обозначен частичный (наведенный) заряд на атоме, причем на углероде заряд d- на водороде d+.
Однако реальное строение метана гораздо более сложное, так как, углерод в его молекуле, так же как и в молекулах других алканов, находиться в состоянии Sp3 гибридизации.
Схема Sp3 гибридизации атома углерода в молекуле метана:
 | |||||
 |  | ||||
 | |||||

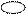
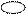
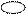 + ®
+ ®



 1s
1s
3p Sp3– гибридные электронные облака
При Sp3 – гибридизации атома углерода 4 его электронные орбитали располагаются в пространстве друг относительно друга под углом 109о28/. Перекрывание гибридных электронных облаков атома углерода с S – электронными облаками атомов водорода в молекуле метана может быть представлено следующим образом:
 |
Молекула метана имеет тетраэдрическое строение
2. Гомологический ряд алканов– в переводе с греческого гомолог – сходный, это ряд каждый предыдущий член которого отличается от последующего члена на группу CH2 – называемую гомологической разностью. Для гомологического ряда алканов общая формула буде иметь вид CnH2n+2. Пользуясь этой формулой можно вывести конкретную формулу любого представителя ряда. Так, например, при n=5 формула соединения будет иметь вид C5H12.
Гомологический ряд алканов (первых 10 представителей) будет выглядеть так:
+CH2 +CH2 +CH2 +CH2 +CH2 +CH2 +CH2 +CH2 +CH2
CH4 ® C2H6 ® C3H8 ® C4H10 ® C5H12 ® C6H14 ® C7H16 ® C8H18 ® C9H20 ® C10H22
Радикал – это частица, обладающая не спаренным электроном. На основе гомологического ряда алканов можно построить и ряд радикалов, причем первичные радикалы отличаются от соответствующих им алканов, тем, что в их составе имеется на один атом водорода меньше. Очень важно выучить наизусть название первых 10 алканов и соответствующих им радикалов, так как названия представителей других классов органических соединений строятся на основе названий алканов.
Начиная с четвёртого представителя ряда алканов при построении названия углеводорода неразветвлённого строения перед основным названием добавляется буква – н, которая и говорит о том, что данный углеводород имеет неразветвлённое строение (например, н - бутан).
В приведенной ниже таблице даны формулы и соответствующие им названия для первых 10 представителей ряда алканов и соответствующих им радикалов.
| Алкан | Название алкана | Радикал | Название радикала |
| CH4 | Метан | СH3 | Метил |
| C2H6 | Этан | C2H5 | Этил |
| C3H8 | Пропан | C3H7 | Пропил |
| C4H10 | Бутан | C4H9 | Бутил |
| C5H12 | Пентан | C5H11 | Пентил |
| C6H14 | Гексан | C6H13 | Гексил |
| C7H16 | Гептан | C7H15 | Гептил |
| C8H18 | Октан | C8H17 | Октил |
| C9H20 | Нонан | C9H19 | Нонил |
| C10H22 | Декан | C10H21 | Децил |
Чтобы построить название радикала, необходимо в название соответствующего алкана заменить суффикс -анна суффикс -ил. Одновалентные углеводородные радикалы имеют общее название алкилы.
Однако помимо первичных радикалов очень часто в соединениях встречаются вторичные и третичные радикалы.
Первичный радикал – это радикал, содержащий первичный атом углерода, то есть такой атом углерода, который соединен в свою очередь лишь с одним другим атомом углерода (или тремя атомами водорода в случае радикала CH3 –метил). Примерами первичных радикалов могут служить: C2H5 – этил, C3H7 – пропил и др.
Вторичный радикал – это радикал, содержащий вторичный атом углерода, то есть такой атом, который в свою очередь соединен с двумя другими атомами углерода. Примерами вторичных радикалов могут служить: изопропил – (CH3)2 – CH – и изобутил (СH3)2 – CH – CH2 – .
Третичный радикал -это радикал, содержащий третичный атом углерода, то есть такой атом углерода, который в свою очередь соединен с двумя другими атомами углерода. Примером третичного радикала может служить трет-бутил – (CH3)3 – C – .
Формулы некоторых вторичных, третичных радикалов, а также двух и трех валентных радикалов, наиболее часто употребляющихся приведены в таблице ниже.
| Радикал | Формула | Радикал | Формула |
| Метилен |   СН2 СН2
| Пропилиден |   CH3 – CH2 - CH CH3 – CH2 - CH
|
| Метин |
  CH – CH –
| Изобутил (первичный изобутил) | (CH3)2CH – CH2 – |
| Этилиден |   СН3 – СH СН3 – СH
| втор-Бутил | CH3 – CH2 – CH(CH3) – |
| Этилидин |
  СН3 – С – СН3 – С –
| трет-Бутил | (СН3)3С – |

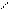

 Названия двухвалентных радикалов (с двумя свободными валентностями у одного и того же атома углерода) производят заменой суффикса –анна–илиден (исключение – радикал метилен CH2). Трехвалентные радикалы имеют суффикс –илидин (исключение – радикал метин – СН).
Названия двухвалентных радикалов (с двумя свободными валентностями у одного и того же атома углерода) производят заменой суффикса –анна–илиден (исключение – радикал метилен CH2). Трехвалентные радикалы имеют суффикс –илидин (исключение – радикал метин – СН).
Сокращенно радикалы обозначают R или Alk. Общая формула одновалентных радикалов CnH2n+1.