 |
|
Электрохимический ряд напряжений метaллов
Восстановительная активность металлов
|
Li K Ba Na Mg Al Mn Zn Cr Fe Cd Со Ni Sn Pb H Cu Hg Ag Au Pt
 |
Окислительная активность катионов металлов
Электрохимический ряд напряжений метaллов
Li K Ba Na Mg Al Mn Zn Cr Fe Cd Со Ni Sn Pb H Cu Hg Ag Au Pt
Окислительная активность катионов металлов |
Формула Нернста:
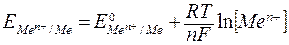
или
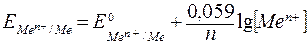 ,
,
где 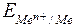 - равновесный электродный потенциал, В;
- равновесный электродный потенциал, В; 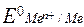 – стандартный электродный потенциал (потенциал для данного электрода при Т = 298 К и [Ме n+] = 1 моль/л), В; R – универсальная газовая постоянная; F – постоянная Фарадея; символ в квадратных скобках означает молярную концентрацию вещества; n – число электронов.
– стандартный электродный потенциал (потенциал для данного электрода при Т = 298 К и [Ме n+] = 1 моль/л), В; R – универсальная газовая постоянная; F – постоянная Фарадея; символ в квадратных скобках означает молярную концентрацию вещества; n – число электронов.
Гальванический элемент
Гальванический элемент состоит из двух электродов, электролиты которых сообщаются.
АНОД: меньшая (более отрицательная или менее положительная) величина Е0 ® реакция окисления;
КАТОД: большая (менее отрицательная или более положительная) величина Е0 ® реакция восстановления.
Например, для медно-серебряного гальванического элемента, состоящего из меди в растворе CuSO4 и серебра в растворе AgNO3:
E0Cu2+/Cu = +0,34B АНОД,
E0Ag+/Ag = +0,80 В КАТОД.
Анодный процесс: окисление металла анода
Me1 – nе– = Ме1n+, Сu0 – 2е– = Сu2+.
Катодный процесс: восстановление катиона металла из соли
Ме2m+ + mе– = Ме2, Ag+ + е– = Ag0.
Суммарное уравнение реакции при работе элемента в общем виде
mMe1 + nМе2m+ = m Ме1n+ + nМе2,
Сu + 2Ag+ = Сu2+ + 2Ag
или в молекулярной форме:
Сu + 2AgNO3 = Cu(NO3)2 + 2Ag.
Электрохимическая схема гальванического элемента, состоящего из двух ионно-металлических электродов:
| Me1 | Электролит1 || Электролит2 | Ме2 анод катод |
В схеме «|» обозначает границу между металлом и электролитом, а «||» – электролитический контакт. В схеме гальванического элемента слева записывают анод, справа – катод.
Для рассматриваемого примера: (–)Cu | CuSO4 || AgNO3 | Ag (+).
Напряжение на гальваническом элементе, соответствующее бесконечно малому току во внешней цепи, называется электродвижущей силой (ЭДС) гальванического элемента. Ее расчет:

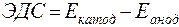
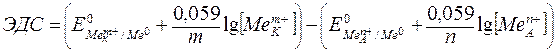
Для рассматриваемого примера:
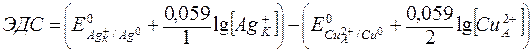
Электролиз
Электролиз – совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании постоянного электрического тока через расплав или раствор электролита. При электролизе электрическая энергия преобразуется в химическую.
Две полуреакции – реакция окисления и реакция восстановления происходят на разных электродах:
АНОД – окисление,