 |
|
КАТОД – восстановление.
Электролиз расплавов на инертных электродах: разрядка ионов, входящих в состав электролита:
катодный процесс: Men+ + nе– = Ме0,
анодный процесс: Хm– – mе– = Х0.
Например, электролиз расплава бромида натрия приводит к образованию металлического натрия (на катоде) и молекулярного брома (на аноде):
катодный процесс: Na+ + lе– = Na0,
анодный процесс: 2Вr– – 2е– = Вr20.
Электролиз водных растворов веществ: возможность участия воды в электродных реакциях:
катодный процесс: 2Н2О + 2е– = Н2 + 2ОН–,
анодный процесс: 2Н2О – 4е– = О2 + 4Н+.
Не участвуют в электродных реакциях:
– катионы металлов, стоящих в таблице стандартных электродных потенциалов от Li до Аl включительно (например, Li+, Rb+, K+, Cs+, Ba2+, Ca2+, Na+, Mg2+, Al3+);
– фторид анион F– и анионы кислородсодержащих кислот (например, NO3–, SO42–, CO32–, PO43–).
Вместо указанных частиц участниками электродной реакции являются молекулы воды (см. таблицу).
Например, электролиз водного раствора бромида натрия (NaBr):
катодный процесс: 2Н2О + 2е– = Н2 + 2ОН–,
анодный процесс: 2Вr– – 2е– = Вr20.
Катодные процессы при электролизе
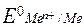 , В , В
| Уравнения процесса | |
| в водном растворе | в расплаве | |
| Е0 > – 0,15 | Men+ + nе– = Ме0 | Men+ + nе– = Ме0 |
| – 0,15 > Е0 > – 1,6 | Men+ + nе– = Ме0 2Н2О + 2е– = Н2 + 2ОН– | |
| Е0 ≤ – 1,6 | 2Н2О + 2е– = Н2 + 2ОН– |
Анодные процессы при электролизе водных растворов веществ
| Состав электролита | Уравнения процессов |
| Бескислородные кислоты HnX и их соли | Хm– – mе– = Х0 |
| Щелочи | 4ОН– – 4е– = О2 + 2Н2О |
| Кислородсодержащие кислоты, фторид-анион и их соли | 2Н2О – 4е– = О2 + 4Н+ |
Закон Фарадея:
 ,
,
где m - масса вещества, образующегося на электроде, кг или г; V - объем газа, образующегося на электроде, м3 или мл; F - константа Фарадея, 96500 Кл/моль; I -сила тока, A; τ - продолжительность электролиза, с; Мэкв - молярная масса эквивалента, кг/моль·экв или г/моль·экв; Vmэкв - молярный объем эквивалента, м3/моль·экв или мл/моль·экв (молярный объем при нормальных условиях (Р=105 Па и Т=273 К) равен 22,4 л).
Коррозия
Коррозия – процесс самопроизвольного разрушения металлов и сплавов при их взаимодействии с окружающей средой.
Классификация коррозии металлов по механизму протекания коррозионных процессов:
– химическая коррозия (при отсутствии электролитов, например, высокотемпературная газовая коррозия при работе двигателя);
– электрокоррозия (под действием блуждающих токов, например, вблизи линий электропередач);
– электрохимическая коррозия металлов (в токопроводящих средах, содержащих электролиты, например во влажном воздухе или в морской воде).
Электрохимическая коррозия металлов – совокупность пространственно разделенных процессов окисления (анодный процесс) и восстановления (катодный процесс).
Анодный процесс: окисление металла с более отрицательной величиной электродного потенциала:
Ме – nе– = Меn+.
Катодный процесс: восстановление частиц, присутствующих в электролите на катоде (металл с менее отрицательным электродным потенциалом).
В кислых средах: 2Н+ + 2е– = Н2.
В нейтральных и щелочных средах (влажный воздух, морская вода, почвенные воды нейтрального характера и т.п.):
О2 + 2Н2О + 4е– = 4ОН–.
Продукты коррозии:
– соли металла-анода и газообразный водород (в кислых средах);
– гидроксиды металла-анода (в нейтральных и щелочных средах).
Принципиальные методы защиты металлов от коррозии:
1. Структура металла
– чистота металла (отсутствие примесей, провоцирующих коррозионный процесс);
– введение легирующих добавок.
2. Изоляция металлов от окружающей среды
– изолирующие покрытия
– неметаллические (лаки, краски, эмали, битум, резина, синтетические смолы, полимерные материалы и т.п.);
– металлические (анодные – из металла с меньшим электродным потенциалом, катодные – из металла с большим электродным потенциалом);
– химическая обработка поверхности (оксидирование, фосфатирование, пассивация концентрированными кислотами и т.п.).
3. Обработка среды
– деаэрация (удаление или снижение концентрации кислорода);
– обессоливание (удаление или снижение концентрации солей);
– использование инертных сред при обработке металлов;
– применение ингибиторов.
4. Электро- и электрохимические методы
– протекторная защита (защищаемый металл – катод, протектор – анод);
– катодная защита (внешний источник постоянного тока, защищаемый металл – к отрицательному полюсу, вспомогательный электрод – к положительному).