 |
|
в водных растворах (при 298 К)
| Электролит | КД | Электролит | КД |
| Азотистая кислота HNO2 | 5,1 ∙ 10–4 | Аммония гидроксид NН4OH | 1,8 ∙ 10–5 |
| Алюминиевая кислота НА1О2 | К1= 6 ∙ 10–13 | Алюминия гидроксид А1(ОН)3 | К1 = 7,4∙ 10–9 К2 = 2,1∙ 10–9 К3 = 1,05∙ 10–9 |
| Борная кислота Н3ВО3 | К1 = 5,8∙ 10–10 К2 = 1,8∙ 10–13 К3 = 1,6∙ 10–14 | Бария гидроксид Ва(ОН)2 | К2 = 2,3∙ 10–1 |
| Бромноватистая кислота НОВr | 2,1 ∙ 10–9 | Бериллия гидроксид Ве(ОН)2 | К1 = 3,2∙ 10–7 К2 = 5,0∙ 10–9 |
| Кремниевая кислота H2SiО3 | К1 = 2,2∙ 10–10 К2 = 1,6∙ 10–12 | Висмута гидроксид Bi(OH)3 | К1 = 3.1∙ 10–12 К2 = 1.0∙ 10–12 К3 = 3.7∙ 10–13 |
| Муравьиная кислота НСООН | 1,8∙ 10–4 | Вода Н2О | 1,8∙ 10–16 |
| Селеноводородная кислота H2Se | К1 = 1,6∙ 10–4 К2 = 1,0∙ 10–11 | Железа (II) гидроксид Fe(OH)2 | К2 = 1,3∙ 10–4 |
| Сернистая кислота H2SO3 | К1 = 1,6∙ 10–2 К2 = 6,3∙ 10–8 | Железа (III) гидроксид Fe(OH)3 | К2 = 1,82∙ 10–11 К3 = 1,35∙ 10–12 |
| Сероводородная кислота H2S | К1 = 1,0∙ 10–7 К2 = 1,2∙ 10–13 | Кадмия гидроксид Cd(OH)2 | К1 = 8,1∙ 10–4 К2 = 4,2∙ 10–3 |
| Теллуристая кислота Н2ТеO3 | К1 = 3∙ 10–3 К2 = 2∙ 10–8 | Кальция гидроксид Cа(OH)2 | К2 = 5,9∙ 10–7 |
| Теллуроводородная кислота Н2Те | К1 = 1∙ 10–3 К2 = 1∙ 10–11 | Кобальта гидроксид Cо(OH)2 | К1 = 7,9∙ 10–5 К2 = 7,8∙ 10–6 |
| Угольная кислота Н2СО3 | К1 = 4,5∙ 10–7 К2 = 4,7∙ 10–11 | Марганца гидроксид Мn(ОН)2 | К2 = 5∙ 10–4 |
| Уксусная кислота СН3СООН | 1,8∙ 10–5 | Меди гидроксид Сu(ОН)2 | К2 = 3,4∙ 10–7 |
| Хлорноватистая кислота НОCl | 3,0 ∙ 10–8 | Никеля гидроксид Ni(OH)2 | К2 = 2,5∙ 10–5 |
| Фосфорная кислота Н3РО4 | К1 = 7,2∙ 10–3 К2 = 6,2∙ 10–8 К3 = 4,6∙ 10–13 | Свинца гидроксид Рb(ОН)2 | К1 = 9,6∙ 10–4 К2 = 3∙ 10–8 |
| Фтороводородная кислота HF | 6,7∙ 10–4 | Серебра гидроксид AgOH | 1,1 ∙ 10–4 |
| Циановодородная кислота HCN | 4,9∙ 10–10 | Хрома гидроксид Сг(ОН)3 | К2 = 3,6∙ 10–9 К3 = 8,9∙ 10–11 |
| Щавелевая кислота Н2С2О4 | К1 = 6,0∙ 10–2 К2 = 5,4∙ 10–5 | Цинка гидроксид Zn(OH)2 | К1 = 4,4∙ 10–5 К2 = 1,5∙ 10–9 |
Таблица 6.Стандартные потенциалы металлических и газовых
электродов (Т= 298 К)
| Электрод | E0298, В | Электрод | E0298, В |
| Li+/Li | - 3,045 | Ni2+/Ni | - 0,250 |
| Rb+/Rb | - 2,925 | Sn2+/Sn | - 0,136 |
| К+/К | - 2,925 | Pb2+/Pb | - 0,126 |
| Cs+/Cs | - 2,923 | Fe3+/Fe | - 0,036 |
| Ra2+/Ra | - 2,916 | H+/H2 | + 0,000 |
| Ba2+/Ba | - 2,906 | Ge2+/Ge | + 0,010 |
| Ca2+/Ca | - 2,866 | Cu2+/Cu | + 0,337 |
| Na+/Na | - 2,714 | O2/OH– | + 0,401 |
| La+/La | - 2,522 | Cu+/Cu | + 0,521 |
| Mg2+/Mg | - 2,363 | Ag+/Ag | + 0,799 |
| Be2+/Be | - 1.847 | Hg2+/Hg | + 0,854 |
| Al3+/A1 | - 1,662 | Pd2+/Pd | + 0,987 |
| Ti2+/Ti | - 1,628 | Вг2/Вr– | + 1,065 |
| V2+/V | - 1,186 | Pt2+/Pt | + 1,200 |
| Mn2+/Mn | - 1,180 | O2/H2O | + 1,229 |
| Cr2+/Cr | - 0,913 | Cl2/Cl– | + 1,359 |
| Zn2+/Zn | - 0,763 | Au3+/Au | + 1,498 |
| Cr3+/Cr | - 0,744 | Au+/Au | + 1,691 |
| Fe2+/Fe | - 0,440 | H2/H– | + 2,200 |
| Cd2+/Cd | - 0,403 | F2/F– | + 2,866 |
| Co2+/Co | - 0,277 |
Таблица 7.Стандартные окислительно-восстановительные
потенциалы (T= 298 К)
| Электродный процесс | E0298, В |
| H3AsO4(aq) + 2H+ + 2e– = HAsO2(aq) + 2 H2O Вr2 + 2e– = 2Вr– 2НВrO + 2Н+ +2e– = Br2 + 2H2O HBrO + H+ + 2e– =Br– + H2O 2ВrО3– + 12Н+ + 10e– = Вr2 + 6Н2О ВrО3– + 6Н+ + 6е– = Вr– + 3Н2О ВrО3– + 3Н2О + 6е– = Вr– + 6ОН– ВrО3– + 2Н2О + 4е– = ВrO– + 4ОН– СН3СООН + 2Н+ +2e– = СН3СНО 2СО2 + 2Н+ + 2e– = Н2С2О4 Сl2 + 2e– = 2Сl– 2НОСl + 2Н+ + 2е– = Сl2 + Н2О НОСl + Н+ + 2е– = Сl– + Н2О СlО– + Н2О + 2e– = Сl– + 2ОН– ClO3– + 6H+ + 6e– = Cl– + 3H2O 2 ClO3– + 12Н+ + 10 e– = Сl2 + 6Н2О ClO4– + 8Н+ + 8e– = Сl– + 4Н2О ClO4– + 4Н2О + 8e– = Сl– + 8OН– Сr3+ + e– = Сr2+ Сr(ОН)2 + 2e– = Сr + 2ОН– Сr(ОН)3 + 3e– = Сr + 3ОН– CrO42–+ 4Н+ +3e– = СrО2 + 2Н2О СrО2– + 2Н2O + 3е– = Сr + 4ОН– Cr2O72– + 14H+ + 6e– = 2Сr3+ + 7Н2О СrО42– + 4Н2O + 3e– = Сr(ОН)3 + 5OН– F2 + 2e– = 2F– F2 + 2H+ + 2e– = 2HF Fe3+ + e– = Fe2+ Fe(OH)3 + e– = Fe(OH)2 + OH– FeS + 2e– = Fe + S2– 2Н+(10–7 моль/л) + 2e– = Н2 Н2 + 2e– = 2Н– 2Н2О + 2е– = Н2 + 2ОН– I2 + 2е– =2I– 2НIO + 2Н+ + 2e– = I2 + 2Н2О НIO + Н+ + 2e– =I– + Н2О IO3– + 5Н+ + 4е– = НIO + 2Н2О 2IO3– + 12Н+ + 10е– =I2 + 6Н2О 2IO3– + 6Н2О + 10е– = I2 + 12OН– IO3– + 6Н+ + 6e– = I– + 3Н2О IO3– + 3Н2О + 6e– = I– + 6ОН– Мn3+ + е– = Мn2+ МnО2 + 4Н++2е– = Мn2+ + 2Н2О MnO42– + 4H+ + 2e– = MnO2 + 2H2O МnО2 + 2Н2О + 2e– =Мn(OН)2 + 2ОН– МnО4– + е– = МnО42– МnО4– + 4Н+ + 3е– = МnO2 + 2Н2O МnО42– + 2Н2О + 2e– = МnО2 + 4ОН– МnО4– + 8Н+ + 5e– =Мn2+ + 4Н2О HNO2 + H+ + e– = NO + H2O NO2– + H2O + e– = NO + 2OH– 2HNO2 + 6H+ + 6e– = N2 + 4H2O NO3– + 3H+ + 2e– = HNO2 + H2O NO3– + H2O + 2e– =NO2– + 2OH– NO3– + 2H+ +e– = NO2 + H2O NO3– + 4H+ + 3e– = NO + 2H2O NO3– + 10H+ + 8e– = NH4+ + 3H2O O3 + 2H+ + 2e– = O2 + H2O О3 + Н2О + 2e– = О2 + 2ОН– O2 + 4H+ + 4e– = 2H2O О2 + 4Н+(10–7моль/л) + 4e– = 2Н2О О2 + 2Н2О + 4е– =4ОН– О2 + 2Н+ + 2e– = Н2О2 Н2О2 + 2Н+ + 2e– = 2Н2О Р + 3Н2О + 3е– = РН3 + 3ОН– Н3РО4 + 2Н+ + 2е– = Н3РО3 + Н2О Рb4+ + 2e– = Рb2+ PbO2 + 4H+ + 2e– = Pb2+ + 2H2O S + 2e– = S 2– S + 2Н+ + 2e– = Н2S (aq) SO32– + 6H+ + 4e– = S + 3Н2О S4O62– + 2e– = 2S2O32– SO42– + 4H+ +2e– = H2SO3 + H2O SO42– + H2O + 2e– = SO32– + 2OH– SO42– + 8H+ + 6e– = S + 4H2O SO42– + 4H2O + 6e– = S + 8OH– S2O82– + 2e– = 2SO42– H2SO3 + 4H+ + 4e– = S + 3H2O SO42– + 8H+ + 8e– = S2– +4H2O SO42– + 10H+ +8e– = H2S + 4H2O Se + 2e– = Se2– Se + 2H+ + 2e– = H2Se (aq) SeO32– + 3H2O + 4e– = Se + 6OH– SeO42– + H2O + 2e– = SeO32– + 2OH– SeO32– + 6H+ + 6e– = Se2– + 3 H2O H2SeO3(aq) + 6H+ + 6e– = H2Se(aq) +3H2O SeO42– + 4H+ + 2e– = H2SeO3(aq) + H2O H2SiO3 + 4H+ + 4e– = Si + 3H2O Sn4+ + 2e– = Sn2+ SnO32– + 6H+ +2e– = Sn2+ + 3H2O | + 0,56 + 1,09 + 1,60 + 1,34 + 1,52 + 1,45 + 0,61 + 0,54 – 0,12 – 0,49 + 1,36 + 1,63 + 1,50 + 0,88 + 1,45 + 1,47 + 1,39 + 0,54 – 0,41 – 1,40 – 1,30 + 0,94 – 1,20 + 1,33 – 0,13 + 2,87 + 3,06 + 0,77 – 0,56 – 0,98 – 0,41 + 2,25 – 0,83 + 0,54 + 1,45 + 0,99 + 1,14 + 1,19 + 0,21 + 1,08 + 0,26 + 1,51 + 1,23 + 2,26 – 0,50 + 0,56 + 1,69 + 0,6 + 1,51 + 0,9б – 0,46 + 1,44 + 0,94 + 0,10 + 0,80 + 0,96 + 0,87 + 2,07 + 1,24 + 1,23 + 0,87 + 0,40 + 0,68 + 1,77 – 0,89 – 0,29 + 1,8 + 1,46 – 0,48 + 0,142 + 0,60 + 0,09 + 0,17 – 0,93 + 0,36 – 0,75 + 2,01 + 0,45 + 0,15 + 0,3 – 0,92 – 0,39 – 0,36 + 0,05 + 0,27 + 0,36 + 1,15 + 0,74 – 0,15 + 0,84 |
Таблица 8. Растворимость солей, кислот и оснований в воде
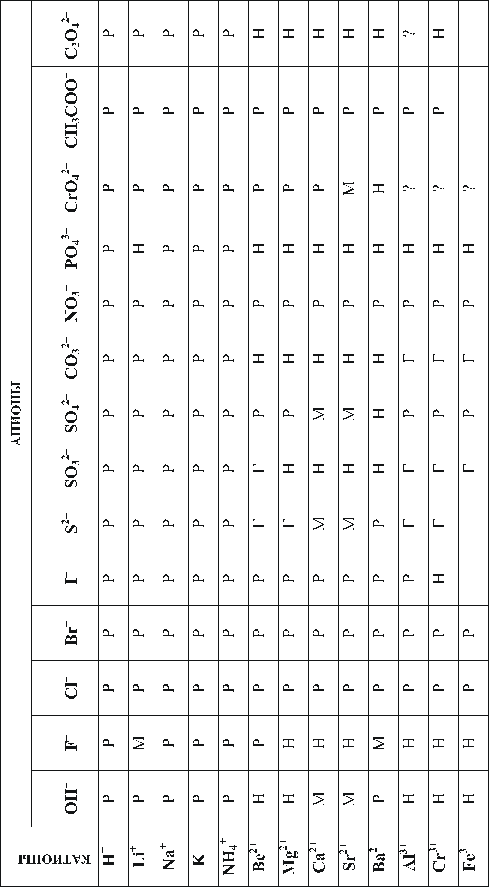
Продолжение


Список литературы
1. Глинка Н. Л. Общая химия.- Л.: Химия, 1987.
2. Коровин Н.В. Общая химия.- М.: Высшая школа, 2000.
3. Общая химия / Под ред. Е.М. Соколовской и Л.С. Гузея. – М.: Изд-во Моск. ун-та, 1989.
4. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия: в двух книгах – М.: Химия, 1990.
5. Кнорре Д.Г., Крылова Л.Ф., Музыкантов В.С. Физическая химия – М.: Высш. шк., 1990.
6. Лабораторные работы по химии / Под ред. Н.В. Коровина. – М.: Высшая школа, 2001.
7. Сборник задач и упражнений по общей и неорганической химии / Н.Н. Павлов, В.И. Фролов и др.; под ред. Н.Н. Павлова. – М.: Дрофа, 2005.
8. Задачи и упражнения по общей и неорганической химии / И.И. Беляева, Е.И. Сутягин, В.Л. Шелепина. – М.: Просвещение, 1989.
9. Краткий справочник физико-химических величин. / Под ред. А. А. Равделя и А. М. Пономаревой. - СПб.: Спец. лит-ра, 2002. (см. также более ранние издания).
10. Справочник по электрохимии / Под ред. А.М. Сухотина. – Л.: Химия, 1981.
Содержание
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 1. 2. 3. 4. 5. 6. 7. 8. | Часть 1. Строение атома Периодическая система Д.И. Менделеева Химическая связь Химическая термодинамика Химическая кинетика Химическое равновесие Растворы электролитов Коллигативные свойства растворов Окислительно-восстановительные реакции Электрохимия Коллоидные растворы Методы анализа химических соединений Перечень умений и навыков Часть 2. Приложение Некоторые фундаментальные физические постоянные Термодинамические константы некоторых веществ Плотность водных растворов некоторых неорганических веществ при 20°С Относительные электроотрицательности некоторых атомов Константы диссоциации некоторых слабых электролитов в водных растворах (при 298 К) Стандартные потенциалы металлических и газовых электродов (Т= 298 К) Стандартные окислительно-восстановительные потенциалы (T= 298 К) Растворимость солей, кислот и оснований в воде Список литературы Содержание |