 |
|
ІІІ. ХІМІЧНИЙ ЗВ’ЯЗОК. БУДОВА МОЛЕКУЛ І КРИСТАЛІВ
1. Який хімічний зв’язок називається ковалентним? Чим пояснюється напрямленість ковалентного зв’язку? Як метод валентних зв’язків (ВЗ) пояснює будову молекули води?
2. У яких випадках утворюються речовини з іонним, ковалентним неполярним і ковалентним полярним зв’язками? Навести приклади.
3. Який тип утворення ковалентного зв’язку називається донорно-акцепторним? Які хімічні зв’язки існують в іонах NH 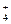 і BF
і BF  ? Вказати донор і акцептор.
? Вказати донор і акцептор.
4. Який ковалентний зв’язок називається s-зв’язком, який π-зв’язком? Розібрати на прикладі.
5. Розподілити електрони атома сірки по електронним коміркам. Скільки неспарених електронів мають його атоми в нормальному і збудженому станах? Яка при цьому буде валентність сірки?
6. Що називається дипольним моментом? Які з молекул HCl, HBr і HJ мають найбільший дипольний момент? Чому?
7. Які кристалічні структури називають іонними, атомними, молекулярними і металевими? Яку кристалічну структуру мають такі речовини: алмаз, хлорид натрію, діоксид вуглецю, цинк?
8. Скласти електронні схеми будови молекул F2, H2S, CCl4. В яких молекулах ковалентний зв’язок буде полярним?
9. Чим відрізняється структура кристалів NaCl від структури натрію? Який зв’язок виникає в цих кристалах?
10. Який зв’язок називається водневим? В яких випадках він виникає? Чим пояснити, що Н2О і HF плавляться і киплять при більш високій температурі, чим HCl, HBr та HI?
11. Який хімічний зв’язок називається іонним? Який механізм його утворення? Які властивості іонного зв’язку відрізняють його від ковалентного? Навести два приклади типових сполук з іонним зв’язком.
12. Складіть електронні формули атомів і наведіть схеми перекривання атомних орбіталей у молекулах: Cl2, HF, H2O, N2.
13. Дати визначення ступеню окислення? Визначити ступінь окислення вуглецю в сполуках: СаC2, H2CO3, CO2,, СО.
14. Які кристалічні структури називають іонними, атомними, молекулярними і металевими? Яку структуру мають кристали алмаза, хлориду кальцію, діоксида вуглецю, цинка?
15. Чому сірка не може мати валентність рівну одиниці?
16. Природа і характеристики іонного і ковалентного зв’язків.
17. Опишіть sp- гібридизацію атомних орбіталей. Наведіть приклади молекул, утворених за рахунок sp-гібридизації атомних орбіталей.
18. Утворення ковалентного зв’язку. Параметри ковалентного зв’язку.
19. Напрямленість ковалентного зв’язку. Пояснити механізм s- та p- зв’язку.
20. Як утворюється іонний зв’язок? Параметри іонного зв’язку. Будова сполук з іонним зв’язком.
21. Характеристики металічного зв’язку? Для яких металів цей зв’язок найбільш характерний?
22. Як утворюється водневий зв’язок? Чому вода має відносно велику температуру кипіння?
23. Дайте характеристику видам міжмолекулярної взаємодії. Які види міжмолекулярної взаємодії діють в речовинах: CO2, H2O, H2?
24. Опишіть sp2-гібридизацію атомних орбіталей. Наведіть приклади молекул, утворених за рахунок sp2-гібридизації атомних орбіталей.
25. Опишіть sp3-гібридизацію атомних орбіталей. Наведіть приклади молекул, утворених за рахунок sp3-гібридизації атомних орбіталей.
26. Дайте характеристику ковалентного зв’язку (неполярного, полярного).
27. Як зміниться характер хімічного зв’язку в з’єднаннях атомів елементів другого періоду з фтором?
28. Наведіть графічні формули сполук та вкажіть тип хімічного зв’язку в цих сполуках: KOH, NaHCO3, H2O2.
29. Складіть електронні формули атомів і наведіть схеми перекривання атомних орбіталей у молекулах: CH4, BeCl2, SiCl4, H2O. В яких з наведених молекул однаковий тип гібридизації атомних орбіталей?
30. Пояснити різницю хімічних зв’язків натрію й хлориду натрію.
31. Чи можуть атоми одного й того ж самого елемента утворювати металічний і іонний зв’язок? Відповідь поясніть.
32. Наведіть приклади молекул, у яких зв’язок між атомами здійснюється однією, двома, трьома парами електронів.
33. В якій з наведених сполук найбільш виражена полярність зв’язку: сірководень, хлор, метан, хлороводень?
34. До якого елемента зміщена спільна електронна пара у сполуках, формули яких: HCl, CO2, NH3, OF2?