 |
|
Классическая теория теплоЁмкости
идеального газа
Средняя энергия одной молекулы равна:  ,
,
где i – число степеней свободы молекулы.
Внутренняя энергия 1 моля идеального газа, содержащего число Авогадро молекул, равна  .
.
Для nмолей газа внутренняя энергия равна  .
.
Теплоёмкостью тела называется количество теплоты, которое нужно подвести к телу, чтобы повысить его температуру на 1 градус (например, теплоёмкость калориметра):
СТЕЛА  [Дж/К]. (44)
[Дж/К]. (44)
Теплоёмкость 1 моля называют молярной теплоёмкостью С (или Сm) [Дж/(моль×К)]. Тогда
Q = Cm n (T2 – T1). (45)
Теплоёмкость единицы массы вещества называют удельной теплоёмкостью с [Дж/(кг×К)]. Тогда
Q = c m (T2 – T1). (46)
Молярная и удельная теплоёмкости связаны через молярную массу:

 (47)
(47)
(или Cm v = M cv, Cm p = M cp, где cV и cP см. далее).
Пусть нагревание 1 моля газа происходит при V = const. Тогда из первого начала термодинамики следует dА = 0 и dQ = dU, и молярная теплоёмкость при постоянном объёме равна


 . (48)
. (48)
Из уравнения (48) можно получить важное соотношение:
dU = CV dT , а внутренняя энергия n молей равна U = n CV T .
Пусть нагревание 1 моля газа происходит при p = const. Тогда молярная теплоёмкость при постоянном давлении равна
 .
.
Разделим уравнение первого начала термодинамики на dT:
 ,
, 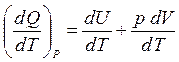 ,
,  .
.
Для нахождения производной dV/dT выразим объём из уравнения Менделеева-Клапейрона для 1 моля: V = RT/p. Итак:
 .
.
Мы получили уравнение Майера:
 . (49)
. (49)
Кроме того, выражение dA/dT = R определяет физический смысл газовой постоянной R: газовая постоянная численно равна работе, которая совершается при расширении 1 моля идеального газа, нагретого на 1 градус при постоянном давлении.
Молярная теплоёмкость при постоянном давлении может быть выражена из уравнения Майера (49):
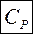

 . (50)
. (50)
Отношение теплоёмкостей
 (51)
(51)
представляет собой характеристическую для каждого газа величину (это показатель адиабаты).
Для одноатомного газа (i = 3) g = 1,67.
Для двухатомного газа (i = 5) g = 1,4.
Для трехатомного газа (i = 6) g = 1,33.
Полученные формулы для теплоёмкости дают хорошее совпадение с экспериментом для одноатомных и многих двухатомных газов (H2, O2, N2) при комнатной температуре. Однако существуют и различия эксперимента и теории, которые объясняются квантовой теорией теплоёмкости.