 |
|
Реальные газы. Критическое состояние
Реальные газы (H2, O2, N2) подчиняются законам идеальных газов, когда они имеют малую плотность (это выполняется при комнатных температурах и атмосферном давлении). При увеличении давления и снижении температуры наблюдаются значительные отклонения от уравнения pV = nRT, поскольку при увеличении плотности начинают играть всё большую роль собственный объём молекул и силы притяжения между ними. Реальные газы обладают такими свойствами, которые не могут быть получены из уравнений для идеальных газов.
Пусть в прозрачном цилиндре с поршнем, манометром и термометром (рис. 34) имеется углекислый газ. Начнем сжимать газ изотермически при комнатной температуре. При некотором давлении газ начнет конденсироваться. При этом в объёме существуют две фазы - жидкая и газообразная. Пока идет конденсация, давление остается постоянным, а объём газа уменьшается за счет перехода газа в жидкость. Поршень опускается до тех пор, пока полностью не ляжет на жидкость. Затем давление резко возрастает, и изотерма круто идет вверх, так как сжимаемость жидкости мала. Изотерма реального газа показана на рис. 35.
Горизонтальный участок реальной изотермы соответствует равновесному состоянию газа со своей жидкостью. Такой газ называют насыщенным паром. Давление рH, при котором осуществляется равновесие при данной температуре, называется давлением (упругостью) насыщенного пара.
Семейство реальных изотерм показано на рис. 36. Существует такая критическая изотерма, для которой горизонтальные участки стягиваются в критическую точку К. Критическая точка определяется критической температурой ТК, критическим давлением рК и удельным (молярным) критическим объемом VК.
Зависимость плотности r жидкости и насыщенного пара показана на рис. 37. При критической температуре исчезают различия в плотностях жидкости и насыщенного пара, и вещество становится однородным. Обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения (так как исчезает сама поверхность жидкости).
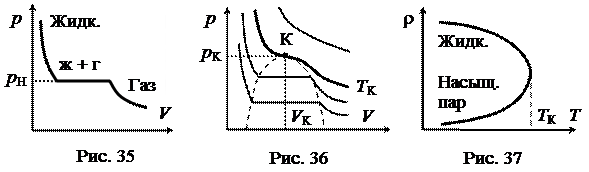 | |||
 | |||
Колоколообразная кривая, соединяющая крайние точки горизонтальных участков изотерм, и критическая изотерма делят диаграмму (p, V) на четыре области (рис. 38). При температуре выше критической образование жидкости уже ни при каких давлениях невозможно. В этой области справедливы уравнения иде 
 ального газа (а вблизи критической изотермы – уравнения реального газа). Чтобы газ сконденсировать, его нужно охладить ниже критической температуры. Поэтому ниже критической изотермы располагаются область жидкого состояния, область двухфазных состояний (жидкость и насыщенный пар) и область пара. Термин «пар» обычно применяют к газу, который при изотермическом сжатии можно сконденсировать.
ального газа (а вблизи критической изотермы – уравнения реального газа). Чтобы газ сконденсировать, его нужно охладить ниже критической температуры. Поэтому ниже критической изотермы располагаются область жидкого состояния, область двухфазных состояний (жидкость и насыщенный пар) и область пара. Термин «пар» обычно применяют к газу, который при изотермическом сжатии можно сконденсировать.
Если в справочнике посмотреть критические температуры различных газов [водород (– 240 °С), азот (– 147 °С), кислород (– 119 °С), углекислый газ (+ 31 °С), вода (+ 374 °С)], то понятно, почему газы, составляющие воздух, при комнатных температурах являются «идеальными», а для опыта, изображенного на рис. 34, выбран углекислый газ.