 |
|
Расчет теоретической осмолярности
Теоретическую осмолярность (мОсмоль/л) рассчитывают при условии предположительно полной диссоциации всех молекул солей, присутствующих в растворе, по формуле (4.1). Поскольку мольные концентрации очень малы, их выражают, для удобства расчетов, в миллимоль/л.
Сосм = 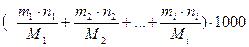 (4.1)
(4.1)
где m1, m2,…, mi  - масса 1-го, 2-го, …i-го вещества в 1 л раствора, г;
- масса 1-го, 2-го, …i-го вещества в 1 л раствора, г;
М1, М2,…, Мi - молярная масса 1-го, 2-го, …i-го вещества, г/моль;
n1, n2, …, ni- количество ионов, образующихся из молекулы при условии полной диссоциации 1-го, 2-го, …i-го вещества;
1000 – коэффициент перевода моль в ммоль.
Пример расчета осмолярности раствора Дисоль
Состав:
NaCl 6 г
CH3COONa 2 г
Воды для инъекций до 1 л
Сосм = 
Согласно современным требованиям маркировки на этикетке контейнера с ИФР необходимо указывать не только теоретическую осмолярность, но и количественный ионный состав.
Пример расчета ионного состава раствора Дисоль

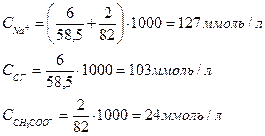
Итого: 254 мОсмоль/л
Определение фактической осмолярности
Фактически значение осмолярности всегда ниже расчетного, так как в реальных растворах полной диссоциации молекул не происходит вследствие электростатического взаимодействия между ионами. В многокомпонентных системах наблюдается значительный разброс активности отдельных неорганических ионов из-за их взаимного влияния и разброс фактической осмолярности.
Существует несколько экспериментальных методов определения осмолярности водных растворов:
· По понижению температуры замерзания раствора по сравнению с чистым растворителем (криометрический метод);
· По различию между давлением пара над раствором и чистым растворителем (паровая осмометрия).
· По способности полупроницаемых мембран избирательно пропускать молекулы веществ (мембранная осмометрия). Применяется только для растворов высокомолекулярных веществ.