 |
|
Металлоорганические соединения
Алкилгалогениды реагируют со щелочными металлами в инертных растворителях, образуя соответствующие металлоорганические соединения:
AlkHal + 2 M → AlkM + MHal
M = Na, Li
При взаимодействии алкилгалогенидов с натрием реакция не останавливается на стадии образования алкилнатрия. Вследствие очень высокой реакционной способности последний сразу реагирует с исходным алкилгалогенидом с образованием алкана (реакция Вюрца, подробнее см. ч.1, лекция 1):

Натрийорганические соединения обычно горят на воздухе, плохо растворяются в большинстве органических растворителей и поэтому не находят широкого применения.
Литийорганические соединения получают по той же схеме, что и натрийорганические. Они не столь активны и лучше растворимы в органических растворителях.
AlkHal + 2 Li → AlkLi + LiHal
Из металлоорганических соединений подробнее других изучены магнийорганические. Их получают взаимодействием алкилгалогенидов с магнием в эфире. В отсутствие эфира магний с алкилгалогенидами не взаимодействует:

По имени открывшего и впервые изучившего их исследователя эти соединения называют реактивами Гриньяра.
Лекция 13. ГАЛОГЕНПРОИЗВОДНЫЕ НЕПРЕДЕЛЬНЫХ
УГЛЕВОДОРОДОВ. ГАЛОГЕНПРОИЗВОДНЫЕ
АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Изомерия. Номенклатура. Три типа галогенпроизводных с двойной связью.
Винилгалогениды. Способы получения: из вицинальных дигалогенидов, алкенов и ацетиленовых углеводородов. Строение винилхлорида, причины инертности винилгалогенидов в реакциях нуклеофильного замещения. Электрофильное присоединение галогенов и галогенводородов. Промышленные способы получения винилхлорида. Поливинилхлориды.
Аллилгалогениды. Способы получения: из алкенов (аллильное хлорирование и бромирование), присоединение галогенводородов к сопряженным диенам. Строение аллилгалогенидов. Причины их повышенной реакционной способности в реакциях SN1 и SN2.
Галогенпроизводные ароматических углеводородов. Гомологический ряд. Изомерия. Классификация. Номенклатура. Способы получения: из бензола и его гомологов, галогенирование в ядро и боковую цепь, условия реакции, механизм. Химические свойства. Реакции нуклеофильного замещения галогена. Причины инертности арилгалогенидов. Механизмы реакции. Влияние электроноакцепторных заместителей на реакционную способность.
НЕНАСЫЩЕННЫЕ ГАЛОГЕНПРОИЗВОДНЫЕ
Ненасыщенные галогенпроизводные в зависимости от удаления атома галогена от кратной связи делят на три группы:
а) атом галогена находится при атоме углерода с кратной связью
(СН2=СН-Cl) – винилгалогенид;
б) галоген удален от кратной связи на одну метиленовую группу
(СН2=СН-СН2-Cl) – аллилгалогенид;
в) галоген удален более чем на одну метиленовую группу
(СН2=СН-(СН2)2-Cl).
а) Хлористый винил СН2=СН-Cl можно получить в результате следующих химических превращений:

Рассмотрим химические свойства этих соединений в двух аспектах: а) влияние двойной связи на реакционную способность галогена; б) влияние галогена на реакционную способность двойной связи.
Галогенпроизводные группы «а» отличаются малой подвижностью галогена, что объясняется эффектом сопряжения неподеленной пары электронов галогена с электронами кратной связи, приводящего к изменению кратности связи (больше 1) С-Cl, увеличению энергии связи и уменьшению ее длины.

Данные по дипольным моментам и длинам связей (табл. 13.1) подтверждают это рассуждение.
Таблица 13.1
Дипольные моменты, энергии и длины связей хлорэтана и хлорэтилена
| Вещество | Длина связи С-Сl, Å | Дипольный момент, D | Энергия связи, ккал/моль |

| 1,77 | 2,02 | |

| 1,69 | 1,44 |
Обычные реакции нуклеофильного замещения, характерные для алкилгалогенидов, невозможны для хлористого винила и подобных ему соединений.

С другой стороны, атом галогена в значительной степени снижает электронную плотность С=С благодаря своему отрицательному индукционному эффекту, и реакции электрофильного присоединения по С=С связи затрудняются.
Присоединение происходит в соответствии с правилом Марковникова:

Реакция присоединения протекает через стадию образования более стабильного катиона (1).

б) Галоген находится в a-положении по отношению к кратной связи:

Хлористый аллил получают в промышленности высокотемпературным хлорированием пропилена:

Для галогена этой группы соединений характерна максимальная реакционная способность (подвижность) в реакциях замещения. Это связано со способностью аллилгалогенидов к диссоциации:
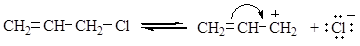
Способность к диссоциации объясняется большей устойчивостью образующегося карбониевого катиона по сравнению с алкильным карбониевым катионом:

В этом случае p-электроны С=С связи в большей степени гасят положительный заряд, чем положительный индукционный эффект алкильной группы и эффект сверхсопряжения в алкилгалогенидах. Реакция замещения атома хлора в аллилгалогенидах протекает по механизмам SN1, в этом случае возможна перегруппировка.

в) Галоген удален от двойной связи двумя и более С-С связями:

В этом случае свойства галогена аналогичны свойствам галогена в галоидных алкилах, а свойства двойной связи аналогичны свойствам кратной связи в алкенах.
АРОМАТИЧЕСКИЕ ГАЛОГЕНПРОИЗВОДНЫЕ
Делятся на две группы:
1. Соединения, содержащие галоген в ароматическом ядре:

2. Соединения, содержащие галоген в боковой цепи:

Способы получения ароматических
галогенпроизводных с галогеном в ядре
Галогенирование
Хлор– и бромпроизводные бензола получают реакцией галогенирования в присутствии кислот Льюиса (электрофильное ароматическое замещение SE, см. ч.1, лекция 10):

Иодпроизводные получить таким образом невозможно, так как реакция обратима. Реакцию обычно проводят в присутствии окислителя.
Присутствие окислителя (например, HNO3) необходимо, т.к. он окисляет НI до иодноватистой кислоты и способствует протеканию реакции в прямом направлении.

Из солей диазония

Способы получения ароматических
галогенпроизводных с галогеном в боковой цепи
Для получения таких соединений пригодны все методы получения алкилгалогенидов.
1. Прямое галогенирование
Этот способ является наиболее распространенным. Реакция протекает по радикальному механизму:

Можно ввести второй и третий атомы галогена. При этом образуются ди– и тризамещенные производные:

2. Хлорметилирование
Реакция хлорметилирования в присутствии кислот Льюиса (AlCl3, ZnCl2) – электрофильное замещение.

Параформ – полимер формальдегида, при пропускании HCl деполимеризуется, образуя хлорметильный катион +СН2Сl, реагирующий с ароматическим кольцом.
Практически хлорметилирование целесообразнее, чем алкилирование с последующим галогенированием, так как при хлорметилировании образуется один продукт, а галогенирование алкилпроизводных бензола дает смесь галогенидов.
Физические свойства
Галогенпроизводные бензола и его гомологов – жидкости или кристаллические вещества. Из полихлорпроизводных бензола кристаллическим является п-дихлорбензол (т. пл. 53ºС). Плотность галогенпроизводных бензола больше 1. Температура кипения повышается от фторпроизводных к йодпроизводным.
Соединения с галогеном в ядре имеют «ароматический» запах. Соединения с галогеном в боковой цепи в α-положении к ядру обладают раздражающим действием (лакриматоры).
В воде все соединения этого ряда нерастворимы, растворяются в большинстве органических растворителей.
Химические свойства
Рассмотрим галогенпроизводные с галогеном в ядре. В обычном понимании галогенпроизводные такого типа неактивны, так же как и галогенпроизводные типа CH2=CH-Cl.
1. Реакции нуклеофильного замещения, характерные для алкилгалогенидов, не характерны для арилгалогенидов.
Инертность галогенпроизводных в реакциях нуклеофильного замещения объясняется наличием сопряжения неподеленных электронных пар галогена с p-сопряженной системой бензольного кольца, что приводит к уменьшению частичного положительного заряда атома углерода бензольного кольца.
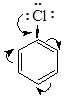
Реакции нуклеофильного замещения протекают в более жестких условиях:

Предполагают, что реакция в этом случае протекает через стадию дегидрирования с образованием дегидробензола и последующим присоединением:

Способность к реакциям нуклеофильного замещения возрастает, если в орто– и пара-положениях к галогену находится сильная электроноакцепторная группа. Это обусловлено тем, что на атоме С, связанном с атомом галогена, увеличивается положительный заряд, и атом углерода легко взаимодействует с нуклеофильными агентами с вытеснением атома галогена:

Галоген в ядре дезактивирует бензольное кольцо в реакциях электрофильного замещения и направляет электрофильный агент в орто– и пара-положения.
Арилгалогениды легко образуют реактив Гриньяра:

Фенилмагнийбромид – очень реакционноспособное вещество. Группа MgBr легко замещается на другие группировки.
Легко получаются и литийпроизводные бензола:

Отдельные представители
В технике из галогеналканов наибольшее применение имеют хлористый метил и хлористый этил. В химической промышленности их применяют как алкилирующие средства. Хлористый этил применяется в больших количествах для получения антидетонатора тетраэтилсвинца (ТЭС), а также в медицине для кратковременного наркоза и для местной анестезии (обезболивания), в частности, в зубоврачебной практике.
Из галогенпроизводных непредельных углеводородов наибольшее техническое значение имеют хлористый винил, хлористый аллил, тетрафторэтилен, хлоропрен.
Полимеры хлористого винила широко применяются в производстве изоляционных материалов и других изделий.
Хлоропрен применяется для получения синтетического каучука, устойчивого к истиранию и воздействию огня, плохо пропускающего газы.
Тетрафторэтилен полимеризуется с образованием продукта, известного под названием тефлон. Из тефлона, благодаря его исключительной химической и биологической инертности, изготовляют стойкие к действию агрессивных сред детали аппаратуры, а также искусственные кровеносные сосуды.
В ряду ароматических галогенпроизводных углеводородов наибольшее значение имеют хлорбензол, п-дихлорбензол, хлористый бензил.
Хлорбензол применяется в химической промышленности в качестве промежуточного продукта в производстве анилина, фенола, инсектицидов.
п-дихлорбензол используют в качестве «лярвицида» (средства, убивающего личинок насекомых – вредителей сельскохозяйственных культур) и средства против моли.
Хлористый бензил является промежуточным продуктом в производстве бензилового спирта – важного полупродукта парфюмерной промышленности.
СПИРТЫ И ФЕНОЛЫ
Лекция 14. ОДНОАТОМНЫЕ СПИРТЫ
Предельные одноатомные спирты. Гомологический ряд. Общая формула. Классификация: первичные, вторичные, третичные спирты. Номенклатура. Способы получения: гидролиз галогеналканов, гидратация алкенов, восстановление карбонильных соединений и сложных эфиров. Синтез спиртов по реакции Гриньяра. Характеристика связей С-О и О-Н. Водородные связи. Физические свойства спиртов. Химические свойства. Кислотность. Константа кислотности. Образование алкоголят-анионов. Реакции с минеральными кислотами. Реакции нуклеофильного замещения: с галогенводородными кислотами, галогенидами фосфора и серы. Особенности SN1 и SN2 реакций спиртов.
Реакции отщепления. Механизм, направление отщепления. Карбкатионы и их перегруппировка. Ацилирование спиртов. Ацилирующий агент. Окисление и дегидрирование спиртов.
Спирты можно разделить на три большие группы: простые спирты, стерины и углеводы. Примеры структур спиртов представлены на рис. 14.1.

Рис. 14.1. Примеры структур спиртов
Алифатические спирты (предельные, одноатомные) – это соединения, содержащие гидроксильную группу (-ОН), связанную с углеводородным радикалом. Общая формула CnH2n+1OH.
Спиртам можно давать название в соответствии с IUPAC, рациональной и тривиальной номенклатурами.
Согласно системе IUPAC, низшие спирты называют алканолами – к названию соответствующего алкана прибавляют окончание -ол (метанол, этанол). При этом за основу названия принимают наиболее длинную углеродную цепь, содержащую ОН-группу. Атомы углерода основной цепи нумеруют таким образом, чтобы атом, связанный с гидроксильной группой, получил наименьший номер.
Согласно карбинольной (рациональной) системе, метанол называют карбинолом, а остальные спирты рассматривают как производные карбинола. Например, этанол по карбинольной системе называют метилкарбинолом, а 2-метил-2-пропанол – триметилкарбинолом и т.д.
Часто спирты называют, прибавляя к названию соответствующей алкильной группы слово «спирт». Низшие спирты обычно имеют тривиальные названия (метанол – древесный спирт, этанол – винный спирт и т.д.).
спирты классифицируют как первичные, вторичные, третичные по атому углерода, с которым связана гидроксильная группа.

Лабораторные методы получения спиртов
1. Гидролиз галогеналканов в водных растворах щелочей происходит по механизму нуклеофильного замещения (см. лекцию 12).

2. Гидратация алкенов. Присоединение воды к алкену протекает в присутствии кислотных катализаторов (H2SO4, H3PO4, оксид алюминия и другие носители, обработанные кислотами).

Этим методом в крупных масштабах получают низшие спирты, из них важнейшим продуктом является этанол:

из пропилена и н-бутилена – изопропиловый и н-бутиловый спирты:


а из изобутилена – трет-бутиловый спирт:
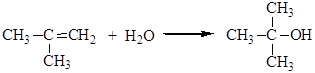
Электрофильный механизм гидратации уже рассматривался ранее. Присоединение протекает по правилу марковникова, реакционная способность алкенов определяется сравнительной стабильностью образующихся карбокатионов и изменяется в ряду:
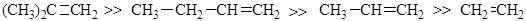
3. Восстановление карбонильных соединений (кетонов и альдегидов), сложных эфиров. Альдегиды и кетоны легко восстанавливаются водородом в присутствии катализаторов (например, Ni, Pd, Pt) в соответствующие первичные и вторичные спирты:


Для восстановления карбонильной группы также широко используются комплексные гидриды металлов – боргидрид натрия NaBH4 (растворитель – вода, этанол) или алюмогидрид лития LiAlH4 (растворитель – абсолютный эфир). Карбонильные соединения также можно восстанавливать атомарным водородом, образующимся при взаимодействии металлического натрия с этиловым спиртом.
4. Синтезы спиртов с использованием реактивов Гриньяра. При взаимодействии реактивов Гриньяра (RMgHal) и литийорганических соединений с карбонильными производными образуются алкоголяты металлов, которые при действии воды или разбавленной кислоты можно превратить в соответствующие спирты. Взаимодействие реактивов гриньяра с формальдегидом, другими альдегидами и кетонами представляет собой прекрасный способ получения первичных, вторичных и третичных спиртов:

Промышленные методы получения спиртов
1. Окисление алканов (синтез спиртов С10-С20). Спирты нормального строения С10-С20 представляют интерес в качестве сырья для синтеза поверхностно-активных веществ. Производство этих спиртов путем окисления парафина по методу А.Н. Башкирова было впервые разработано и реализовано в СССР. Окисление ведут кислородом воздуха в присутствии 4-5% борной кислоты, которая связывает образующиеся спирты в эфиры, не подвергающиеся дальнейшему окислению:
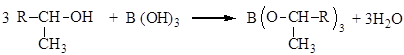
Полученные спирты, образующиеся без деструкции углеродной цепи, являются преимущественно вторичными, с примесью гликолей и кетоспиртов.
Эта фракция как сырье для ПАВ не имеет большой ценности, и метод широкого распространения не получил.
2. Синтез спиртов по методу Фишера-Тропша. При высоком давлении СО и Н2 образует смесь кислородсодержащих соединений (синтол) – спиртов, альдегидов, кетонов, карбоновых кислот и сложных эфиров. Этот метод нашел широкое применение для синтеза метанола:

3. Процесс оксосинтеза. Реакция открыта Реленом в 1938 г. Назначение процесса – получение из алкенов и синтез-газа (СО+Н2) альдегидов и их гидрирование до спиртов:

Первичные спирты С10-С18 линейного строения являются сырьем для производства ПАВ типа алкилсульфатов, которые отличаются высоким индексом биоразлагаемости; спирты С7-С9 служат полупродуктами для получения сложноэфирных пластификаторов, особенно фталатов.
4. Ферментативный гидролизуглеводов под действием бактерий Clostridium acetobutilicum. Этим методом получают н-бутанол в смеси с ацетоном.
Физические свойства спиртов
Многие физические и химические свойства спиртов, особенно низкомолекулярных (относительно высокие температуры кипения, значительная растворимость в воде), обусловлены способностью гидроксильной группы образовывать межмолекулярные водородные связи.

По мере удлинения углеводородной цепи относительное влияние водородных связей уменьшается, и одноатомные спирты с длинной углеродной цепью приближаются по своим физическим свойствам к соответствующим алканам. Так, только низшие спирты – метиловый, этиловый, изопропиловый и третичный бутиловый – смешиваются с водой в любых соотношениях, а, например, н-гексанол растворяет лишь 0,6% воды.
Таблица 14.1
Температуры кипения спиртов
| Спирт | Температура кипения, °С |
| СН3ОН | 64,5 |
| С2Н5ОН | 78,3 |
| н-С3Н7ОН | 97,8 |
| н-С4Н9ОН | 117,7 |
| н-С10Н21ОН | 231,0 |
Спирты нормального строения кипят выше, чем спирты с разветвленной цепью (табл. 14.1). При одинаковом числе углеродных атомов первичные спирты кипят при более высокой температуре, чем вторичные, а вторичные спирты – при более высокой, чем третичные. Температуры плавления, наоборот, выше у третичных спиртов. Плотность спиртов меньше 1.
Химические свойства спиртов
В молекуле спирта можно выделить три реакционных центра:

1) О-Н-связь: обладает выраженной полярностью вследствие высокой электроотрицательности кислорода по сравнению с водородом, реакции с разрывом О-Н-связи определяют кислотность спирта;
2) неподеленная электронная пара атома кислорода определяет основность и нуклеофильность спирта;
3) С-О-связь: также обладает полярностью из-за различия электроотрицательности кислорода и углерода, разрыв С-О-связи характерен для реакций нуклеофильного замещения и β-элиминирования.
В соответствии с перечисленными реакционными центрами для спиртов можно выделить следующие реакции:
1) кислотно-основные;
2) нуклеофильное замещение гидроксильной группы;
3) дегидратация спиртов;
4) окисление спиртов.
1. Кислотные и основные свойства спиртов. Спирты способны проявлять себя как кислоты и как основания. Константа диссоциации этанола Ка (рКа=10-16) в 1010 раз выше, чем Ка ацетилена (рКа=10-26).

В силу своих кислотных свойств спирты легко взаимодействуют со щелочными металлами, образуя соли (алкоголяты):
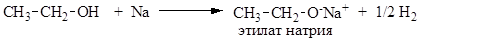
Кислотность спиртов определяется строением алкильного радикала. Так, кислотность в ряду низших спиртов меняется следующим образом:
Н2О (рКа=15.7) > CH3OH (pKa=11.2) > CH3CH2OH (pKa=15.8) > (CH3)2CHOH (pKa=16.9) > (CH3)3COH(pKa=19.2)
Наименьшую кислотность имеет трет-бутиловый спирт, так как соответствующий алкоксид-анион наименее устойчив из-за электронодонорного влияния метильных групп:

Основные свойства спиртов проявляются по отношению к протонным и апротонным кислотам. Донором электронов в молекуле спирта является атом кислорода:

Основность спиртов изменяется в ряду: (CH3)3COH > (CH3)2CHOH > CH3CH2OH > CH3OH.
2. Взаимодействие с неорганическими кислотами. Спирты взаимодействуют с кислородсодержащими минеральными кислотами с образованием сложных эфиров неорганических кислот. Многоосновные кислоты образуют кислые и средние эфиры. Взаимодействие с серной кислотой проводят при низких температурах:

При нагревании этил– и метилсульфатов образуются соответствующие средние эфиры – диэтил– и диметилсульфаты:

Диметилсульфат – хороший метилирующий агент.
Высшие спирты, особенно вторичные и третичные, под действием серной кислоты легко образуют алкены и не образуют эфиров в таких условиях.
Метилнитрат получают взаимодействием метилового спирта с азотной кислотой:

Для получения нитратов двух– и трехатомных спиртов применяют смесь азотной и серной кислот. Многие полинитраты неустойчивы и при ударе взрываются.
Некоторые моноэфиры фосфорной кислоты широко распространены в природе, например, фосфаты углеводов. ДНК и РНК являются полимерными эфирами фосфорной кислоты.
3. Нуклеофильное замещение гидроксильной группы на галоген. К реакциям нуклеофильного замещения относится замещение гидроксильной группы на галоген, амино-, алкоксигруппу и др. Гидроксид-анион, который выступает в роли уходящей группы, относится к числу трудно замещаемых групп. Чтобы осуществить нуклеофильное замещение гидроксильной группы в спиртах, последние необходимо модифицировать таким образом, чтобы гидроксид-анион не выступал в роли уходящей группы. Часто реакции проводят в присутствии сильных кислот, в этом случае гидроксильная группа протонируется и отщепляется в виде молекулы воды.
Замещение гидроксильной группы на галоген возможно под действием галогенводородных кислот (HCl, HBr) и галогенидов фосфора и серы.
Наиболее важные химические превращения спиртов связаны с заменой гидроксильной группы на галоген под действием галогенводородных кислот:

Реакция протекает по механизму нуклеофильного замещения. В случае первичных спиртов реализуется SN2 механизм:
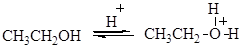

Третичные спирты реагируют по SN1 механизму.
При действии PCl3 и PCl5 на спирты также образуются соответствующие галогенпроизводные:
3 CH3CH2-OH + PCl3 ® 3 CH3CH2-Cl + H3PO4
Взаимодействие спиртов с тионилхлоридом SOCl2 происходит по механизму, отличающемуся от рассмотренных ранее:
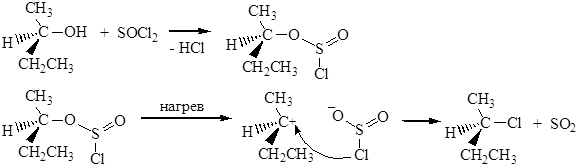
Атака вступающего нуклеофила происходит с той же стороны, откуда отщепляется уходящая группа, поэтому в молекуле сохраняется взаимное расположение атомов, в отличие от реакций Sn1и SN2. Механизм этой реакции нельзя отнести ни к Sn1,ни к SN2. Его обозначают символом Sni (замещение нуклеофильное внутримолекулярное). Реакция спиртов с SOCl2 в присутствии пиридина протекает иначе, по механизму SN2.
4. Реакции отщепления. В реакциях отщепления (элиминирования) Е проявляются основные свойства спиртов:
CH3CH2OH ® CH2=CH2
В качестве катализаторов используют минеральные кислоты (серная, фосфорная), кислые соли (KHSO4), ангидриды кислот (Р2О5), оксид алюминия и т.д. Подробно эти превращения рассмотрены в методах получения алкенов. Кислотная дегидратация спиртов является практически важной реакцией: этим способом в промышленности получают изобутилен (из трет-бутанола), стирол (дегидратацией метилфенилкарбинола), а также изопрен (известный метод синтеза изопрена из изобутилена и формальдегида включает в себя заключительную стадию – дегидратацию диола и ненасыщенного спирта).
Например, этиловый спирт образует этилен по следующей схеме:

Отщепление молекулы серной кислоты может происходить как внутримолекулярно (алкен), так и межмолекулярно (простой эфир).

Вторичные и третичные спирты в кислой среде легко отщепляют воду. Отщепление воды приводит к образованию карбкатиона.
Направление реакции отщепления определяется правилом зайцева: водород отщепляется от наименее гидрогенизированного атома углерода, соседнего с углеродом, несущим гидроксильную группу.
Реакция отщепления протекает по следующему механизму:
1. Протонирование молекулы спирта:

2. Отщепление молекулы воды с образованием алкил-катиона:

3. Отщепление протона с образованием алкена:

В зависимости от строения спирта образуются первичные, вторичные и третичные карбкатионы.
По увеличению стабильности катионы располагаются в следующий ряд:

Любое влияние, делокализующее положительный заряд карбкатиона, ведет к его стабилизации. Мы имеем дело в данном ряду с индукционной стабилизацией и стабилизацией за счет сопряжения sС-Н связей с вакантной орбиталью атома углерода, несущего положительный заряд:

Образующиеся катионы в зависимости от их строения способны к перегруппировкам. Так, например, 3-метил-2-бутанол дает вторичный карбениевый катион, склонный к перегруппировке в более стабильный – третичный.
Стадия 1:
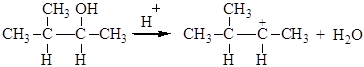
Стадия 2:

Образование последнего связано с гидридным сдвигом (Н-) из положения 3 в положение 2.
В перегруппировке может участвовать и алкильная группа:
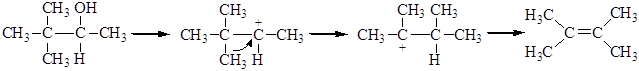
Основное различие между тремя типами реакционных интермедиатов (карбкатионы, карбанионы и свободные радикалы) состоит в том, что карбкатионы имеют тенденцию изомеризоваться в более устойчивые частицы.
5. Окисление. Первичные и вторичные спирты могут быть окислены соответственно до альдегидов и кетонов. Третичные спирты устойчивы к окислению в мягких условиях.
Первичные спирты окисляются до альдегидов под действием окислителей, содержащих Cr(VI). Это обычно хромовая кислота H2CrO4:

Окисление первичного спирта начинается с образования эфира хромовой кислоты RCH2-O-Cr(O)2-OH. На следующей стадии эфир претерпевает реакцию отщепления, в результате которой образуется двойная связь углерод – кислород:

Полученный альдегид далее окисляется до кислоты.

Чтобы избежать окисления альдегида, его отгоняют из реакционной среды. Это возможно, так как получающиеся альдегиды не способны к ассоциации и кипят значительно ниже соответствующих спиртов.
Альдегиды можно также получить окислением первичных спиртов реагентом Саретта (комплекс CrO3 с пиридином).
В относительно мягких условиях происходит окисление спирта раствором оксида хрома (VI) в разбавленной серной кислоте (окисление по Джонсу).
Вторичные спирты легко окисляются до кетонов под действием окислителей: K2Cr2O7 в разбавленной серной кислоте, CrO3 в уксусной кислоте и KMnO4 в кислой среде:


Хромовая смесь окисляет и первичные, и вторичные спирты.
Механизм окисления вторичных спиртов подобен окислению первичных спиртов в альдегиды, поэтому для получения кетонов пригодны методы, описанные выше.
Третичные спирты устойчивы к действию окислителей: они не окисляются ни в нейтральной, ни в щелочной среде. Третичные спирты окисляются в кислой среде. В качестве промежуточного продукта образуется алкен, который далее разлагается по схеме:

Дегидрирование спиртов. Этим способом получают многие альдегиды и кетоны, пропуская пары первичного или вторичного спирта над медным катализатором при 300°С:

В промышленности этот процесс реализуется при получении формальдегида из метанола.
Отдельные представители
Метанол (метиловый, древесный спирт) – бесцветная жидкость со слабым спиртовым запахом. Большое количество его используют в производстве формальдегида, муравьиной кислоты, метил– и диметиланилина, метиламинов и многих красителей, фармацевтических препаратов, душистых веществ. Метанол – хороший растворитель, поэтому он широко применяется в лакокрасочной промышленности, а также в нефтяной промышленности при очистке бензинов от меркаптанов, при выделении толуола азеотропной ректификацией.
Этанол (этиловый, винный спирт) – бесцветная жидкость с характерным спиртовым запахом. Этиловый спирт в больших количествах используется в производстве дивинила (перерабатывается в синтетические каучуки), диэтилового эфира, хлороформа, хлораля, этилена высокой чистоты, этилацетата и других сложных эфиров, применяемых в качестве растворителей лаков и душистых веществ (фруктовые эссенции). В качестве растворителя этиловый спирт широко применяется в производстве фармацевтических, душистых, красящих и других веществ. Этанол – хорошее антисептическое средство.
Пропиловый и изопропиловый спирты. Эти спирты, а также их сложные эфиры применяются как растворители. В ряде случаев они заменяют этиловый спирт. Изопропиловый спирт используют для получения ацетона.
Бутиловый спирт и его сложные эфиры применяют в больших количествах как растворители лаков и смол.
Изобутиловый спирт применяется для получения изобутилена, изомасляного альдегида, изомасляной кислоты, а также в качестве растворителя.
Первичные амиловые и изоамиловые спирты составляют основную часть сивушного масла (побочные продукты при получении этилового спирта из картофеля или злаков). Амиловые спирты и их эфиры – хорошие растворители. Изоамилацетат (грушевая эссенция) применяется при изготовлении прохладительных напитков и некоторых кондитерских изделий.
Лекция 15. МНОГОАТОМНЫЕ СПИРТЫ
Многоатомные спирты. Классификация. Изомерия. Номенклатура. Двухатомные спирты (гликоли). Трехатомные спирты. Глицерин. Синтез жиров и пропилена. Применение гликоля и глицерина в промышленности.
ДвухАТОМНЫЕ СПИРТЫ
Спирты, содержащие несколько гидроксильных групп, называются многоатомными спиртами. Двухатомные спирты называются гликолями или диолами,общая формула таких соединений СnH2n(OH)2.
Две гидроксильные группы не могут находиться у одного атома углерода, такие соединения легко теряют воду, превращаясь в альдегиды или кетоны:

Это свойство типично для всех гем-диолов. Устойчивость гем-диолов повышается при наличии электроноакцепторных заместителей. Примером устойчивого гем-диола является хлоральгидрат:

Гликоли, содержащие гидроксильные группы у разных углеродных атомов, устойчивы.
Изомерия и номенклатура
Изомерия гликолей связана с изомерией углеродного скелета и взаимным расположением гидроксильных групп (α-, β-, γ-гликоли и т.д.)
В двухатомных спиртах гидроксилы могут быть соединены с первичными, вторичными и третичными атомами углерода, поэтому различают гликоли двупервичные, первично-вторичные и т.д.:
1) первично – первичный гликоль:

2) первично – вторичный:
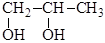
3) двувторичные и т.д.:

Тривиальные названия двухатомных спиртов производятся от названия двухатомного радикала с прибавлением слова гликоль, например, этиленгликоль, пропиленгликоль. По систематической номенклатуре пользуются окончанием -ол с указанием числа гидрокисльных групп – диол и цифр, указывающих положения гидроксильных групп:

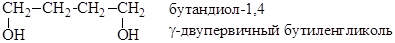
Способы получения
Способы получения двухатомных спиртов аналогичны способам получения одноатомных спиртов.