 |
|
Гидролиз вицинальных дигалогенпроизводных или галогенгидринов

Окисление алкенов водным раствором перманганата калия или пероксидом водорода

3. Гидратация α-окисей

В результате реакции алкоголята и этиленоксида образуются соединения типа ROCH2CH2OH – целлозольвы:
CH3CH2CH2CH2ONa + (CH2)2O + H2O ® CH3CH2CH2CH2-O-CH2CH2OH
Каталитическое восстановление эфиров двухосновных кислот

Восстановление диальдегидов

Физические свойства
Благодаря наличию межмолекулярных и внутримолекулярных водородных связей и большому числу полярных групп гликоли имеют более высокие температуры кипения, чем одноатомные спирты; хорошо растворимы в воде. Низкомолекулярные диолы – густые жидкости, высокомолекулярные – твердые вещества.
СН3СН2ОН т. кип. 78.3°С
СН2(ОН)-СН2ОН т. кип. 197.5°С
Химические свойства
Химические свойства диолов аналогичны свойствам одноатомных спиртов, но они могут вступать в реакции с участием одной или обеих гидроксильных групп. Со щелочными металлами образуют полные и неполные гликоляты, а с минеральными и органическими кислотами – полные и неполные эфиры.
Образование гликолятов

Отличительной особенностью гликолей является реакция с гидроксидом меди с образованием гликолята меди (качественная реакция на вицинальные диолы)

Образование сложных эфиров


Образование простых эфиров

Реакции дегидратации
Для гликолей характерны внутримолекулярные и межмолекулярные реакции дегидратации


Особо рассмотрим дегидратацию α-двутретичных гликолей (пинаконов) в присутствии серной кислоты, приводящую к образованию пинаколинов:

Такая перегруппировка получила название пинаколиновой.Дегидратация пинаконов над оксидом алюминия приводит к алкадиенам.
Окисление
Двухатомные спирты легко окисляются:

Отдельные представители
Этиленгликоль и пропиленгликоль широко используют в производстве антифризов. Этиленгликоль применяется также в синтезе полимерных материалов – полиэтилентерефталата (лавсан), ненасыщенных полиэфиров, полиуретанов, алкидных полимеров и т.д. Из него получают этиленгликольдинитрат (для производства взрывчатых веществ и порохов), а также моно– и диацетаты этиленгликоля, являющиеся хорошими растворителями.
Простые моноэфиры этиленгликоля общей формулы ROCH2-CH2OH называются целлозольвы. Название «целлозольв» относится к 2-этоксиэтанолу. Эти вещества обладают хорошими растворяющими свойствами в отношении эфиров целлюлозы. Бутилцеллозольв – хороший растворитель; он используется в гидравлических тормозных жидкостях и добавляется к авиационному топливу в качестве антифриза.
Карбитолы, являющиеся моноалкиловыми эфирами диэтиленгликоля, применяются в качестве растворителей, а также при изготовлении лаков. Их получают реакцией целлозольва с эквивалентным количеством этиленоксида.
Карбоваксы (полимеры с различными молекулярными массами) получают реакцией этиленоксида с виц-диолами (например, этиленгликолем). Карбоваксы находят применение в качестве смазочных масел, компонентов мазей и жидкой фазы в газожидкостной хроматографии.
ТРЕХАТОМНЫЕ СПИРТЫ
Родоначальником гомологического ряда трехатомных спиртов является глицерин (пропантриол-1,2,3). Это вязкая нетоксичная жидкость с т. кип. 290°С, гигроскопична, смешивается с водой. Используется в пищевой, текстильной промышленности для получения пластмасс, лаков, порохов, ВВ, косметических и лекарственных веществ.
Способы получения
1. Гидролиз жиров. Долгое время единственным источником получения глицерина в промышленных масштабах служило мыловаренное производство (гидролиз жиров – сложных эфиров глицерина и высших карбоновых кислот).
2. Из пропилена. В настоящее время глицерин получают из пропилена по схеме:

3. Из ацетилена:

Химические свойства
По химическим свойствам глицерин не отличается от одно-, двухатомных спиртов. Со щелочными металлами, гидроксидами железа, меди, кальция и бария образует глицераты. С HCl, HBr дает моно– и дигалогенгидрины, с HI – трийодпропан. При действии PCl3, PI3, PBr3 все гидроксильные группы замещаются на галоген. При дегидратации глицерин образует акролеин (непредельный альдегид, образование которого мы наблюдаем при подгорании жиров):

Наиболее интересны сложные эфиры глицерина и кислот (карбоновых и минеральных).
С карбоновыми кислотами глицерин образует сложные эфиры – жиры животного и растительного происхождения:
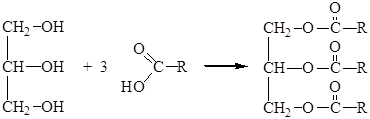
Интересны и сложные эфиры минеральных кислот, например, полный эфир азотной кислоты и глицерина – тринитрат глицерина, или нитроглицерин (тривиальное название химически неверно) – взрывчатое вещество, применяемое для изготовления динамита и бездымного пороха. Динамит, пропитанный нитроглицерином кизельгут, был предложен Нобелем, что принесло ему большую прибыль, которую он завещал на ежегодные премии ученым (Нобелевские премии).
Тринитрат глицерина применяют в медицине в качестве сосудорасширяющего средства. Сам глицерин играет важную роль в обмене веществ, входит в состав липидов.
Ненасыщенные спирты
Простейший ненасыщенный спирт – виниловый – неустойчив и превращается в ацетальдегид; он никогда не был выделен в индивидуальном состоянии:

Другие виниловые спирты также претерпевают аналогичное превращение в соответствующие карбонильные соединения. Известны, однако, простые и сложные эфиры виниловых спиртов, они могут быть получены путем присоединения спиртов и карбоновых кислот к ацетиленам:

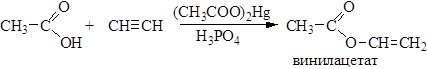
Сложные эфиры виниловых спиртов находят применение при получении многих промышленно важных полимеров.
Аллиловый спирт может быть легко получен гидролизом аллилхлорида:

Он вступает в большинство обычных реакций двойных связей и в соответствии с ожидаемым на основании химических свойств аллилгалогенидов оказывается значительно более реакционно способным, чем насыщенные первичные спирты, по отношению к реагентам, расщепляющим связь С-О:

Двойная связь не оказывает влияния на реакционную способность гидроксильной группы в том случае, если они разделены двумя или большим числом метиленовых групп, как в бутен-3-оле-1: СН2=СН-СН2-СН2ОН.
Лекция 16. Фенолы
Одноатомные фенолы. Изомерия. Номенклатура. Способы получения: из арилгалогенидов, сульфокислот, аминов. Промышленный способ получения фенола из кумола. Химические свойства. Кислотность. Причины стабилизации фенолят-иона. Влияние заместителей на кислотность фенолов. Простые и сложные эфиры фенолов. Реакции электрофильного замещения (галогенирование, нитрование, сульфирование, нитрозирование). Реакция с формальдегидом. Фенолформальдегидные смолы.
Особое место в органической химии занимают фенолы:

Фенол – тривиальное название, которое принято и в номенклатуре ИЮПАК. Многие фенолы сохраняют тривиальные названия:

По числу гидроксильных групп фенолы делят на одно-, двух-, трех– и многоатомные.
Способы получения фенолов
1. Коксование каменного угля. Основная цель этого процесса состоит в производстве металлургического кокса. Побочно образуются жидкие продукты коксования и газ. Перегонкой жидких продуктов коксования наряду с бензолом, толуолом и нафталином получают фенол, тиофен, пиридин и их гомологи, а также более сложные аналоги с конденсированными ядрами. Доля каменноугольного фенола по сравнению с получаемым кумольным методом незначительна.