 |
|
Лабораторна робота №7
Визначення питомої теплоти пароутворення
Бензолу.
Мета роботи – експериментально вивчити залежність тиску насичених парів бензолу від температури, а також визначити питому теплоту випаровування бензолу.
Для опису стану речовини і фазових переходів, що відбуваються в ній, зручно користуватися фазовими діаграми (діаграмою стану). Криві на рис.13 розділяють однорідні стани речовини, які відрізняються своїми фізичними властивостями: газоподібний (г), рідкий (р), твердий (т). Ці стани називають фазами. Для води, наприклад, це пар, вода і лід. Перехід речовини з однієї фази в іншу називається фазовим переходом. Фазові переходи бувають І і ІІ родів. Під час фазових переходів І роду поглинається або виділяється певна кількість теплоти. Температура і тиск при цьому є сталими. До фазових переходів першого роду належать: правління, випаровування, сублімація, тощо.
Криві на фазовій діаграмі відповідають рівновазі між двома фазами. Так крива ОК відповідає рівновазі між рідкою і газоподібною фазами і називається кривою випаровування. В точці перетину всіх трьох кривих (т. О) при строго визначених значеннях тису і температури в рівновазі знаходяться одночасно всі три фази. Ця точка називається точкою потрійною.
Крива випаровування закінчується точкою К – критичним станом речовини, в якому зникає відмінність між фізичними властивостями рідкою і газоподібною фазами.
Фазові переходи І роду описуються рівнянням Клаузіуса-Клапейрона. Доведемо його.
Якщо здійснюється рівноважний фазовий перехід, то зміна ентропії є  , де dQ – теплота, підведена до системи за час процесу при температурі переходу Т. Згідно першому закону термодинаміки теплота dQ, що підводиться до системи, йде на збільшення внутрішньої енергії системи dU і на роботу розширення pdV, тобто
, де dQ – теплота, підведена до системи за час процесу при температурі переходу Т. Згідно першому закону термодинаміки теплота dQ, що підводиться до системи, йде на збільшення внутрішньої енергії системи dU і на роботу розширення pdV, тобто
 або
або  .
.
Виражаючи приріст ентропії внутрішньої енергії в об’ємі як різницю відповідних величин в цих станах, останній вираз можна записати у вигляді:
 або
або  .
.
Остання рівність означає, що функція Ф = U + pV – TS при фазовому переході не змінюється.
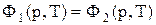 . (1)
. (1)
Функція Ф називається термодинамічним потенціалом, диференціал якого описується формулою:
 . (2)
. (2)
При зміні в системі тиску р і температури Т на малу величину dp і dT маємо інший рівноважний стан:
 .
.
З (2) випливає, що  ;
; 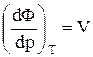 .
.
Підставляючи ці значення похідних в попереднє рівняння, отримаємо
 або
або  .
.
З останнього рівняння отримаємо залежність тиску від температури для рівноваги двох фаз чистої речовини:
 .
.
Зважаючи на те, що при 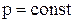 кількість теплоти дорівнює зміні ентальпії
кількість теплоти дорівнює зміні ентальпії 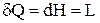 останнє рівняння запишемо у вигляді
останнє рівняння запишемо у вигляді
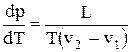 , (3)
, (3)
де L – питома теплота переходу з однієї фази в іншу; v1, v2 – питомі об’єми цих фаз (об’єми одиниці маси). Рівняння (3) носить назву рівняння Клаузіуса-Клапейрона.
Для випадку випаровування (3) запишемо у вигляді
 ,
,
де r – питома теплота пароутворення рідини при температурі переходу Т; v1, v2 – питомі об’єми пару та рідини.
При температурах значно нижчих за критичну питомий об’єм рідини значно менше питомого об’єму пару  і ним можна знехтувати. Крім того, густина насиченого пару дуже мала і для нього можна використати рівняння стану ідеального газу
і ним можна знехтувати. Крім того, густина насиченого пару дуже мала і для нього можна використати рівняння стану ідеального газу
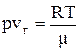 ,
,
де p – тиск насичених пару, m – молярна маса пару. Звідки  . Підставляючи значення vг в рівняння Клапейрона-Клазіуса, отримаємо
. Підставляючи значення vг в рівняння Клапейрона-Клазіуса, отримаємо
 .
.
Якщо прийняти, що теплота випаровування r не залежить від температури, то, інтегруючи, останню рівність, отримаємо  .
.
На практиці теплота пароутворення r – це функція від температури, однак, використовуючи рівняння до вузького інтервалу температур, можна дослідити середнє значення теплоти пароутворення.

Останнє рівняння показує, що в неширокому інтервалі температур залежність 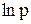 від 1/Т на кривій випаровування лінійна. Тангенс кута нахилу графіка цієї лінії до осі 1/Т буде виражений як
від 1/Т на кривій випаровування лінійна. Тангенс кута нахилу графіка цієї лінії до осі 1/Т буде виражений як 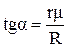 . Таким чином, для визначення середнього значення питомої теплоти випаровування треба по експериментальним значенням р і Т побудувати графік залежності
. Таким чином, для визначення середнього значення питомої теплоти випаровування треба по експериментальним значенням р і Т побудувати графік залежності  і з нього визначити тангенс кута a нахилу одержаної прямої до осі 1/Т, а потім розрахувати середнє значення питомої теплоти випаровування для досліджуваного інтервалу температур:
і з нього визначити тангенс кута a нахилу одержаної прямої до осі 1/Т, а потім розрахувати середнє значення питомої теплоти випаровування для досліджуваного інтервалу температур:  .
.
Для отримання залежності р від Т і визначення питомої теплоти випаровування в даній роботі використовується наступна установка (рис.14). У U-образну трубку залита ртуть, над якою в запаяному кінці знаходиться крапля бензолу, а над нею – насичена пара. Другий кінець U-образної трубки через буферну посудину, манометр, кран, сполучений з насосом, що дозволяє створювати в системі необхідне розрідження. Трубка поміщається в стакан з водою, що підігрівається електроплиткою. Температуру води, а отже, і бензолу вимірюють з допомогою термометра. Тиск насиченої пари бензолу вимірюється манометром, коли рівні ртуті в колінах U-образної трубки врівноважуються. Вимірюючи тиск при різних температурах, одержують шукану залежність.