 |
|
За допомогою електролізу
Виходячи з молекулярно-кінетичного тлумачення поняття температури (міра середньої кінетичної енергії молекул), її слід вимірювати в одиницях енергії. Проте це дуже незручно на практиці (необхідність оперувати досить малими числами: температурі в 1 К відповідає енергія 1.38×10–23Дж, сама процедура вимірювання при цьому значно ускладнюється). Множник k, який виражає співвідношення між одиницями енергії (джоулем) та температурою (кельвіном), називають сталою Больцмана. Її числове значення встановлюють експериментально різними методами, наприклад, використавши явище електролізу.
Електролітами в широкому значенні слова називають речовини, що хімічно розкладають на складові частини, коли по ним проходить електричний струм. До них належать тверді розчини, іонні кристали і, як основні, розчини неорганічних кислот, солей і основ в воді та інших розчинниках. Розпад електроліту на його складові частини під дією електричного струму називається електролізом. Продукти розкладу виділяються на електродах (первинні реакції), тобто струмопровідних тілах належної геометричної форми, що занурені в електроліт і під’єднані до полюсів джерела постійного струму. Ці продукти, як правило вступають в хімічні реакції з електродами або розчинником (вторинні реакції).
Заряди в електролітах переносяться іонами. Згідно теорії електролітичної дисоціації, кожна молекула солей, лугів і кислот складається з двох іонів з протилежними по знаку і рівними по величині зарядами. В розчині зв’язки між іонами слабшають і молекула розпадається (електролітична дисоціація). Зіштовхуючись, іони знов можуть об’єднуватися в нейтральні молекули (рекомбінація).Звичайно процеси дисоціації і рекомбінації протікають одночасно, в розчині встановлюється рухома рівновага і число іонів в одиниці об’єму електроліту буде залишатися сталим.
Еклектичне поле викликає направлений рух іонів в електроліті, тобто електричний струм. Іони з від’ємним знаком (аніони) рухаються до аноду (додатньому електроду), а з додатнім знаком (катіони) – до катоду (від’ємного електроду). Досягнувши анода, аніони віддають йому надлишкові електрони, які передаються в зовнішнє коло і рухаються до катоду. Катіони на катоді придбавають недостатні їм заряди. В результаті цих процесів аніони і катіони стають нейтральними молекулами (атомами).
Вивчаючи явище електролізу англійський фізик М.Фарадей встановив два основні закони електролізу.
1. Перший закон Фарадея. Маса речовини m, що виділилася при електролізі на будь-якому електроді, прямо пропорційна кількості заряду q, що пройшов через електроліт:
 ,
,
де К – електрохімічний еквівалент речовини.
2. Другий закон Фарадея. Електрохімічні еквіваленти пропорційні атомним вагам А і обернено пропорційні їх валентностям Z:
 ,
,
де 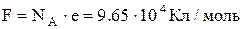 , NА – число Авогадро, е – заряд електрона.
, NА – число Авогадро, е – заряд електрона.
 В даній роботі електролітом є 15 % водний розчин сірчаної кислоти Н2SO4, який заливається в прилад, що одержав назву вольтелектрометра або вольтаметра (рис. 14). Розглянемо основні процеси, що протікають в електроліті при проходженні струму. Молекули води володіють електричним дипольним моментом, на який молекули Н2SO4 надають орієнтуючу дію. Створюване орієнтованими дипольними моментами молекул води електричне поле виявляється таким великим, що молекули
В даній роботі електролітом є 15 % водний розчин сірчаної кислоти Н2SO4, який заливається в прилад, що одержав назву вольтелектрометра або вольтаметра (рис. 14). Розглянемо основні процеси, що протікають в електроліті при проходженні струму. Молекули води володіють електричним дипольним моментом, на який молекули Н2SO4 надають орієнтуючу дію. Створюване орієнтованими дипольними моментами молекул води електричне поле виявляється таким великим, що молекули  розпадаються на іони:
розпадаються на іони:

При включенні електричного поля між двома електродами, позитивні іони Н+ починають дрейфувати до електроду з менший потенціалом, тобто до катода, а іони  у зворотний бік, тобто до анода, на яких будуть відбуватися хімічні перетворення:
у зворотний бік, тобто до анода, на яких будуть відбуватися хімічні перетворення:
на катоді: 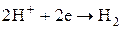 ,
,
на аноді:  .
.
У першому випадку іони Н+ захоплюють електрони на катоді, перетворюються в нейтральні атоми, а потім в молекулярний водень 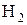 , що виділяється поблизу катода у вигляді газових міхурів. У другому – іони
, що виділяється поблизу катода у вигляді газових міхурів. У другому – іони  віддають електрони аноду і перетворюються в хімічно активні радикали
віддають електрони аноду і перетворюються в хімічно активні радикали  . Вони вступають в хімічну реакцію або з розчинником, або з речовиною анода. Якщо електроди зроблені з платини або нікелю, то молекули
. Вони вступають в хімічну реакцію або з розчинником, або з речовиною анода. Якщо електроди зроблені з платини або нікелю, то молекули  реагують тільки з розчинників, тобто з водою. При цьому виділяється кисень:
реагують тільки з розчинників, тобто з водою. При цьому виділяється кисень:
 .
.
Молекули Н2SO4, що утворюються в такій реакції, поступають в розчин, а молекулярний кисень виділяється у вигляді газових міхурів на аноді. Таким чином, кінцевий результат електролізу зводиться до розкладу води на кисень і водень.
Вольтаметр є U–образною судиною, в кожне коліно якого впаяний електрод. Вгорі кожна трубка для випуску газів забезпечена краном. Об’єм газу, що виділився, визначається за допомогою міток нанесених на трубки. Наповнення приладу електролітом виробляється через особливу трубку, яка в нижній частині з'єднується з U–подібною посудиною, а у верхній частині має розширення. На підставці приладу є дві клеми, сполучені з електродами приладу і службовці для підключення його в ланцюг. При проходженні струму в катодному коліні виділяється водень, стан якого описується рівнянням Менделєєва–Клапейрона:

де р – тиск, Па; V – об’єм, м3; m – маса газу, кг; m – молярна маса, кг/моль; R – універсальна газова стала, Дж/(моль×К); Т – температура, К.
Враховуючи, що  і
і  (де
(де 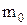 – маса однієї молекули повітря, N – кількість молекул) одержимо
– маса однієї молекули повітря, N – кількість молекул) одержимо
 , (1)
, (1)
де k – стала Больцмана і  .
.
Рівняння (1) дозволяє визначити сталу Больцмана згідно формули:
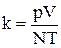 .
.
Число молекул водню Н2, що виділилися в катодному коліні, можна знайти по заряду Q, перенесеному іонами Н+ за час протікання струму

де  – число атомів водню, що утворилися на катоді за час t, е – заряд електрона. Атоми Н швидко рекомбінують, утворюючи молекули Н2, число яких в об'ємі V буде рівне
– число атомів водню, що утворилися на катоді за час t, е – заряд електрона. Атоми Н швидко рекомбінують, утворюючи молекули Н2, число яких в об'ємі V буде рівне  .
.
У експериментах вимірюється сила струму I і час t, протягом якого виділяється водень, що займає об’єм V. Легко зміркувати, що
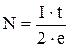 .
.
Використовуючи останній вираз, сталу Больцмана можна обчислити як:
 .
.
Необхідний для розрахунків тиск водню в катодному коліні U – подібної трубки р рівний сумі атмосферному тиску pатм та тиску стовпа рідини, що піднялася в середньому коліні і мінус парціальний тиск насиченої пари води над розчином сірчаної кислоти:
 .
.
де r – густина розчину, pнас – тиск насиченої пари води при температурі електроліту над розчином електроліту, h – висота рідини в середній коліні по відношенню до висоти в катодному коліні.
Згідно закону Раулявідносне зменшення тиску насичених парів розчинника (в нашому випадку води) над поверхнею розчину нелетучої речовини (сірчаної кислоти) дорівнює відношенню числа молей розчиненої речовини 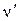 до числа молів розчинника
до числа молів розчинника  :
:
 ,
,
де  і
і  – тиск насичених парів води над поверхнею розчина і чистого розчинника, відповідно. В роботі використовувався водяний розчин з масовою концентрацією сірчаної кислоти 15%.Тоді легко отримати, що
– тиск насичених парів води над поверхнею розчина і чистого розчинника, відповідно. В роботі використовувався водяний розчин з масовою концентрацією сірчаної кислоти 15%.Тоді легко отримати, що
 .
.
Число Лошмідта 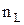 (концентрація атомів за нормальних умов (Т0 = 273 К; р0 = 101.3кПа)) за означенням обчислюється як:
(концентрація атомів за нормальних умов (Т0 = 273 К; р0 = 101.3кПа)) за означенням обчислюється як:
 ,
,
де V0 – об'єм, який займав би водень в катодному коліні при p = p0 і Т = Т0.
Величину V0 знаходиться, використавши об’єднаний газовий закон, згідно рівняння
 .
.
І в результаті одержимо  .
.