 |
|
Лабораторная работа «Изучение зависимости скорости реакции от различных факторов»
Опыт 1.«Влияние концентрации реагирующих веществ на скорость химической реакции»
Цель: Установить влияние концентрации реагирующих веществ на скорость химической реакции.
Изучаемая реакция:
Na2S2O3 + H2SO4 = S↓ + Na2SO4 + H2O
Ход работы: В три пронумерованные пробирки наливают 1М раствор тиосульфата натрия: в первую – 7 капель, во вторую – 14 капель, в третью – 21 каплю. Затем к содержимому первой пробирки добавляют 14 капель воды, во вторую пробирку – 7 капель воды. В три другие пробирки наливают по 7 капель серной кислоты.
Для определения скорости реакции необходимо измерить секундомером время от момента сливания растворов тиосульфата натрия и серной кислоты до появления первых признаков выделяющейся серы (слабое помутнение раствора). Поочередно к каждой пробирке с тиосульфатом натрия прибавляют заранее приготовленный раствор серной кислоты (7 капель) и отмечают, через сколько секунд после сливания начинается помутнение раствора.
Оформление результатов работы:
Полученные данные заносят в таблицу:
| № пробирки | Объем раствора (капли) | Общий объем раствора (капель) | Относительная концентрация тиосульфата натрия (C) | Время появления помутнения t, с | Относительная скорость реакции w=1/t (с-1) | ||
| Na2S2O3 | H2O | H2SO4 | |||||
| - |
Относительную скорость реакции рассчитывают как величину, обратную времени (w=1/t). По результатам опыта строят графическую зависимость относительной скорости реакции от относительной концентрации тиосульфата натрия (по оси абцисс откладывается концентрация, по оси ординат – скорость реакции).
Вывод: Охарактеризуйте зависимость скорости реакции от концентрации реагирующих веществ. Каков порядок этой реакции по тиосульфату натрия?
Опыт 2.«Влияние температуры на скорость химической реакции»
Цель: Установить влияние температуры на скорость химической реакции.
Изучаемая реакция:
Na2S2O3 + H2SO4 = S↓ + Na2SO4 + H2O
Ход работы: В три пронумерованные пробирки наливают по 10 капель раствора тиосульфата натрия с концентрацией 1 моль/л. В три другие пробирки наливают по 10 капель 1М раствора серной кислоты.
Первую пару пробирок (кислота – тиосульфат натрия) и термометр помещают в стакан с водой комнатной температуры, и через 5 минут, когда температура в пробирках выровняется, записывают показания термометра. Содержимое пробирок сливают и встряхивают, измеряя время от момента сливания до момента появления помутнения.
Вторую пару пробирок помещают на 5 минут в стакан с водой, температура которой на 10 градусов выше комнатной.
Далее все манипуляции производят так же, как с первой парой пробирок. Аналогично поступают с третьей парой пробирок, повысив температуру еще на 10 градусов.
Оформление результатов работы:
Полученные данные заносят в таблицу:
| № пробирки | Объем раствора, капли | Температура, оС | Время появления мути, с | Относительная скорость реакции w=1/t (с-1) | |
| Na2S2O3 | H2SO4 | ||||
По результатам опыта строят графическую зависимость относительной скорости реакции от температуры (по оси абцисс откладывается температура, по оси ординат – скорость реакции).
Рассчитайте средний температурный коэффициент реакции по уравнению Вант-Гоффа. Так как ΔТ = 10, температурный коэффициент равен отношению скоростей:
 ;
; 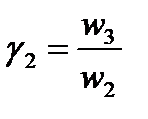 ;
; 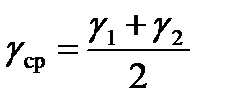
Вывод: Охарактеризуйте зависимость скорости реакции от температуры и приведите рассчитанное значение температурного коэффициента данной реакции.
Практическое занятие №2
Тема: Растворы: способы выражения состава и коллигативные свойства. Приготовление раствора необходимой концентрации методом разбавления более концентрированного раствора.
Цели:
· ознакомить с основными понятиями теории растворов и биологической ролью растворов в живой природе;
· сформировать понятие об основных способах выражения состава раствора;
· научить рассчитывать концентрации растворов, изотоничных крови;
· развивать у студентов мотивацию изучения химии посредством применения полученных знаний для характеристики растворов, используемых в медицинской практике;
· совершенствовать навыки самостоятельной работы с информацией.
задачи обучения:
o студент сможет рассчитывать различные виды концентраций и переходить от одних способов выражения состава раствора к другим;
· студент сможет пользоваться справочной литературой для нахождения необходимых для проведения расчетов величин;
· студент сможет приготовить раствор заданной концентрации из более концентрированного раствора;
· студент сможет приготовить раствор из данной навески и рассчитать его концентрацию;
· студент сможет доложить результаты выполнения лабораторных работ.
Основные вопросы темы:
1. Основные понятия теории растворов.
2. Роль растворов в жизнедеятельности организма.
3. Способы выражения состава растворов.
4. Применений растворов в медицинской практике.
Методы обучения:
Комбинированный:
- семинар (групповое обсуждение студентами темы учебной программы под руководством преподавателя);
- работа в малых группах (выполнение лабораторных работ);